Соединения алюминия
Al2O3 (глинозем)
Оксид алюминия Al2O3 является белым, очень тугоплавким и твердым веществом (в природе тверже только алмаз, карборунд и боразон).
Свойства глинозема:
- не растворяется в воде и вступает с ней в реакцию;
- является амфотерным веществом, реагируя с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]; - как амфотерный оксид реагирует при сплавлении с оксидами металлов и солями, образуя алюминаты: Al2O3 + K2O = 2KAlO2.
В промышленности глинозем получают из бокситов. В лабораторных условиях глинозем можно получить сжигая алюминий в кислороде: 4Al + 3O2 = 2Al2O3.
Применение глинозема:
- для получения алюминия и электротехнической керамики;
- в качестве абразивного и огнеупорного материала;
- в качестве катализатора в реакциях органического синтеза.
Al(OH)3
Гидроксид алюминия Al(OH)3 является белым твердым кристаллическим веществом, которое получается в результате обменной реакции из раствора гидроксида алюминия – выпадает в виде белого студенистого осадка, кристаллизующегося со временем. Это амфотерное соединение почти не растворимое в воде:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]; Al(OH)3 + 3HCl = AlCl3 + 3H2O.
- взаимодействие Al(OH)3 с кислотами:Al(OH)3+3H+Cl = Al3+Cl3+3H2O
- взаимодействие Al(OH)3 со щелочами:Al(OH)3+NaOH- = NaAlO2-+2H2O
Гидроксид алюминия получают путем действия щелочей на растворы солей алюминия: AlCl3 + 3NaOH = Al(OH)3 + 3NaCl.
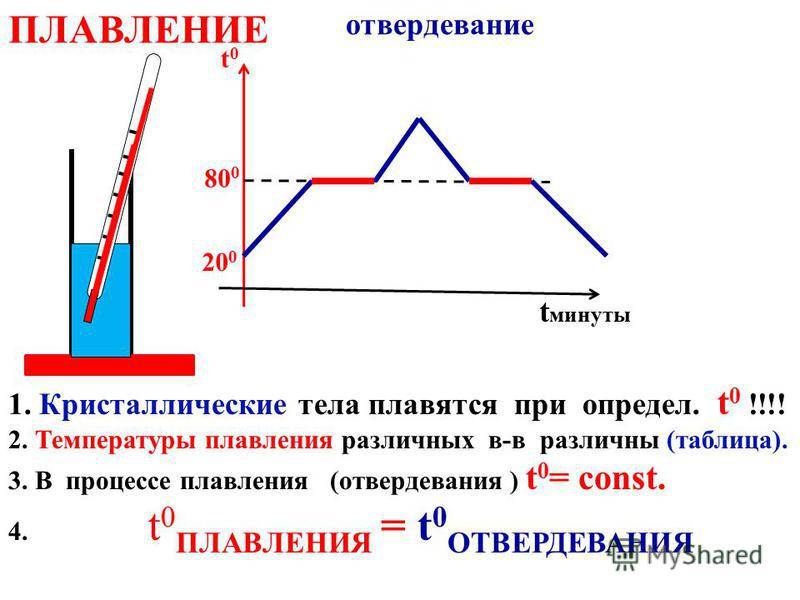
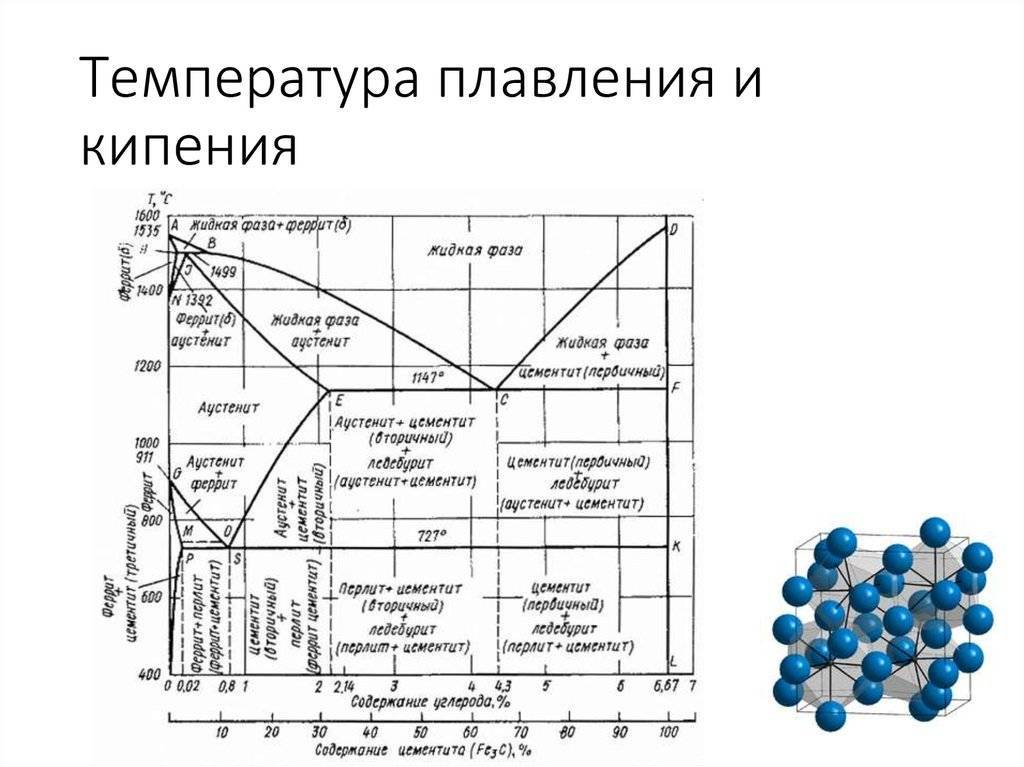
Температура — плавление — свинец
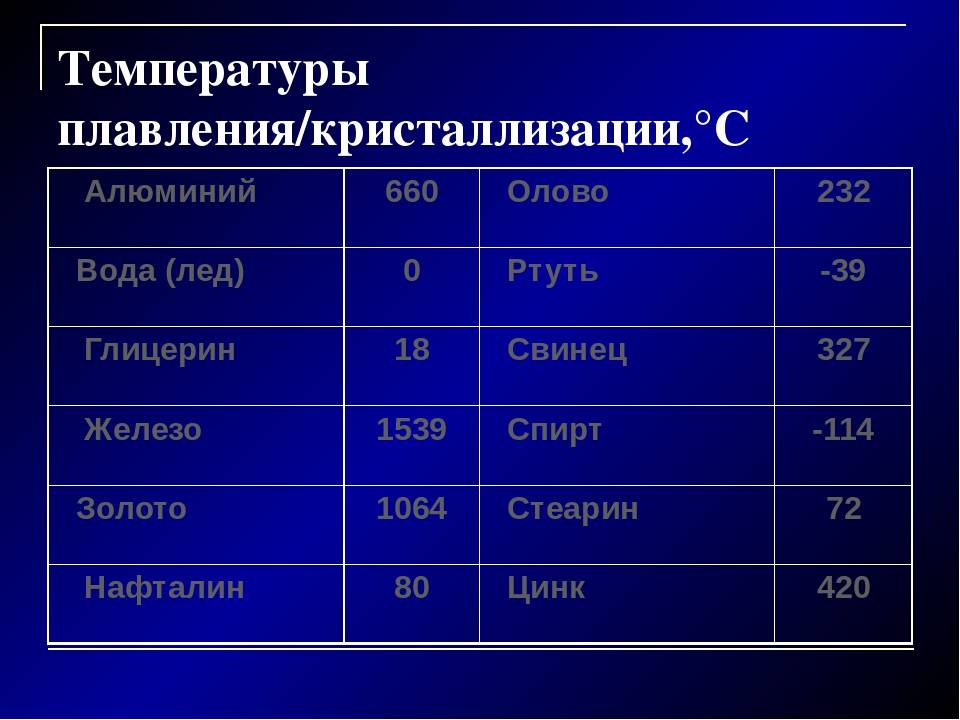
Плавкостью называется способность металлов при определенной температуре переходить из твердого состояния в жидкое. Эта температура называется температурой плавления. Различные металлы имеют различную, но определенную ( для данного металла) температуру плавления. Сплавы не имеют постоянной и определенной температуры плавления, она зависит от количества и свойств элементов, входящих в сплав. Так, например, если температура плавления свинца 327 С, а олова 232 С, то сплав олова ( 62 %) со свинцом ( 38 %), называемый припоем, имеет температуру плавления 183 С.
Плавкостью называется способность металлов при определенной температуре переходить из твердого состояния в жидкое. Эта температура называется температурой плавления. Различные металлы имеют различную, но определенную ( для данного металла) температуру плавления. Сплавы не имеют постоянной и определенной температуры плавления, она зависит от количества и свойств элементов, входящих в сплав. Так, например, если температура плавления свинца 327 С, а олова 232 С, то сплав олова в количестве 62 % со свинцом в количестве 38 % ( так называемый припой) имеет температуру плавления 183 С.
Плавкостью называется способность металлов при определенной температуре переходить из твердого состояния в жидкое. Эта температура называется температурой плавления. Различные металлы имеют различную, но определенную ( для данного металла) температуру плавления. Сплавы не имеют постоянной и определенной температуры плавления, она зависит от количества и свойств элементов, входящих в сплав. Так, например, если температура плавления свинца 327 С, а олова 232 С, то сплав олова ( 62 %) со свинцом ( 38 %), называемый припоем, имеет температуру плавления 183 С.
В тигельных печах обычно нет термопары или термометра для измерения температуры. О примерной температуре в печи судят по цвету нагретого керамического муфеля: темно-красное каление — 700 С, ярко-красное — 950 С, желтое — 1100 С
Через 10 — 12 мин тигель осторожно вынимают, захватив тигельными щипцами. Нужно подчеркнуть, что эту операцию целесообразно выполнять без задержки, не давая тиглю охладиться. При охлаждении металл может иногда приплавиться к тиглю и тогда его трудно извлечь, не разбив тигель
Для восстановления выбирают оксиды низкоплавких металлов ( температура плавления свинца 327 С, олова 232 С), чтобы получить расплавленный металл в лабораторных условиях.
При охлаждении металл может иногда приплавиться к тиглю и тогда его трудно извлечь, не разбив тигель. Для восстановления выбирают оксиды низкоплавких металлов ( температура плавления свинца 327 С, олова 232 С), чтобы получить расплавленный металл в лабораторных условиях.
Свинец пластичен и вязок, легко поддается обработке. Свежий разрез свинца на воздухе быстро тускнеет, так как свинец окисляется кислородом воздуха. Вследствие большой вязкости свинец трудно ломается. Механическая прочность свинца весьма невысокая. Он настолько мягок, что чертится ногтем, легко режется ножом, легко сгибается и рвется даже при сравнительно небольшом усилии. Теплопроводность свинца между 0 и 50 равна 30 ккал мчас С, теплоемкость между О и 100 равна 0 031 ккал. С, коэфициент линейного расширения равен 0 0000276 — 0 0000293, уд. Температура плавления свинца 327 5, поэтому его очень легко можно расплавить в ковше на простом очаге и отлить в любую форму. Простота обработки является наиболее ценным свойством свинца по сравнению с другими материалами.
Цикл плавления отражательной печи
Изменение температурных параметров и потребляемой мощности горелок в отражательной плавильной печи с прямой загрузкой показаны на рисунке 4.
Рисунок 4 – Изменение температурных параметров и
потребляемой мощности горелок в цикле плавления отражательной печи
В начале цикла плавления холодный металл загружается в горячую печь. В результате этого температура футеровки значительно снижается. Твердый металл, который загружен в печь, очень быстро поглощает тепло от газового потока продуктов сгорания. Поток горячих газов во многих случаях ударяет непосредственно в алюминиевую шихту (рисунок 5). На этом этапе общая площадь поверхности шихты очень большая и поэтому происходит эффективная передача тепла от горячих газов продуктов сгорания к шихте. По этой причине отходящие газы печи имеют относительно низкую температуру (см. рисунок 4).
Рисунок 5 – Прохождение горячего потока продуктов сгорания горелки
через алюминиевую шихту: а) полное; б) частичное
По мере нагрева твердой шиты интенсивность ее теплообмена с горячими газами продуктов сгорания снижается. Потребляемая мощность горелок также снижается. Шихта начинает плавиться и принимать плоскую форму (рисунок 6). На этой стадии плавильного цикла температура выходящих из печи газов резко возрастает из-за снижения перепада температуры между горячими газами и металлом, а также уменьшения площади контакта их взаимодействия.
Рисунок 6 – Воздействие горячих газов горелки на плоский расплав в печи
Изоляция
В том же году французский геолог Пьер Бертье обнаружил алюминиевый минерал в месторождении красноватой глины во Франции, в регионе Ле Бо. Бертье обозначил минерал как боксит. Этот минерал в настоящее время является основным источником алюминия.
В 1825 году датский химик Ганс Кристиан Эрстед изготовил металлический стержень из предполагаемого алюминия. Он описал его как «кусок металла, который по цвету и блеску немного похож на олово». Эрстед смог добиться этого за счет восстановления хлорида алюминия, AlCl.3, с амальгамой калия.
Однако считалось, что исследователь получил не чистый алюминий, а сплав алюминия и калия.
В 1827 году немецкому химику Фридриху Вёлеру удалось произвести около 30 граммов алюминиевого материала. Затем, после 18 лет исследовательской работы, Вёлер в 1845 году добился получения глобул размером с булавочную головку, с металлическим блеском и сероватым цветом.
Велер даже описал некоторые свойства металла, такие как цвет, удельный вес, пластичность и стабильность.
Технология плавления алюминия в домашних условиях
Суть плавления состоит из нескольких этапов:
- Подготовка лома. В качестве исходного сырья используют профиль из алюминия, проволоку (ее предварительно уминают пассатижами), отслужившие детали. Кусочки должны быть небольшими. Краску, вкрапления других металлов из них не достают, все это будет в составе шлака.
- Подбор емкости, в которой можно плавить алюминий. Подойдет прочная посудина из стали (температура плавления 1300°С) или чугунок (1100°С), используют готовые огнеупорные тигли.
- Подготовка формы для расплава. В домашних условиях их делают самостоятельно. Процедура изготовления представлена ниже.
- Плавление лома. Предварительно определяют источник тепла.
- Снятие шлака, изготовление отливки. Самый простой способ плавки – аккуратно слить жидкий алюминий в подготовленную емкость или форму, шлак остается на стенках плавильной посудины. Чтобы он не прилип, требуется быстро ее охладить.
В принципе, технология промышленного и кустарного литья ничем не отличается. Лом плавят до состояния текучести. После этого отделяют расплав от шлака, сливают в заготовленные формы. Их после охлаждения отливки разбивают
Важно определить, что в результате должно получиться из жидкого алюминия. Даже если плавить металл решили ради эксперимента, емкость или форму для литья все равно необходимо приготовить
Тогда можно будет рассмотреть получившийся слиток, проверить его на пористость, чистоту, однородность структуры.
Электролиз окиси алюминия
Основным оборудованием для электролиза является специальная ванна, футерованная углеродистыми блоками. К ней подводят электрический ток. В ванну погружаются угольные аноды, сгорающие при выделении из окиси чистого кислорода и образующие окись и двуокись улглерода. Ванны, или электрилизеры, как их называют специалисты, включаются в электрическую цепь последовательно, образуя серию. Сила тока при этом составляет 150 тысяч ампер.
Аноды могут быть двух типов: обожженные из больших угольных блоков, масса которых может быть больше тонны и самообжигающиеся, состоящие из угольных брикетов в алюминиевой оболочке, которые спекаются в процессе электролиза под действием высоких температур.

Рабочее напряжение на ванне обычно составляет около 5 вольт. Оно учитывает и напряжение, необходимое для разложения окиси, и неизбежные потери в разветвленной сети.
Из растворенной в расплаве на основе криолита окиси алюминия жидкий металл, который тяжелее солей электролита, оседает на угольном основании ванны. Его периодически откачивают.

Процесс производства алюминия требует больших затрат электроэнергии. Чтобы получить одну тонну алюминия из глинозема, нужно израсходовать около 13,5 тысяч кВт*ч электроэнергии постоянного тока. Поэтому еще одним условием создания крупных производственных центров является работающая рядом мощная электростанция.
Предостережение
Алюминий не заложен изначально в биологические организмы. Но человек получает его микродозы ежедневно – с пищей.
Им богаты горох, пшеница, рис, овсяный «геркулес». Доказана польза алюминия как стимулятора регенерации, развития тканей, работы ЖКТ, ферментов.
По стандартам РФ, в литре питьевой воды не должно быть более 0,2 мг алюминия.
Алюминиевой посудой пользоваться можно, но ограниченно. Безопасны готовка, подогрев, хранение продуктов с нейтральными характеристиками. Приготовление кислых блюд (щи, томат, компот) опасно. Алюминий поступит в еду, создавая избыточную дозу при попадании в организм, плюс «железный» привкус.
Физические свойства алюминия зависят от его чистоты
Таблица физических свойств алюминия | |
| Температура плавления Тпл, °С | 660 |
| Температура кипения Ткип, °С | 2 327 |
| Скрытая теплота плавления, Дж/г | 393,6 |
| Теплопроводность l , Вт/м град (при 20° С) | 228 |
| Теплоемкость Ср, Дж/(г · град) (при 0–100°С) | 0,88 |
| Коэффициент линейного расширения α × 10-6, 1/°С (пр°С) | 24,3 |
| Удельное электросопротивление ρ × 10-8, Ом× м (при 20°С) | 2,7 |
| Предел прочности σ в, МПа | 40–60 |
| Относительное удлинение δ , % | 40–50 |
| Твердость по Бринеллю НВ | 25 |
| Модуль нормальной упругости E , ГПа | 70 |
Плотность алюминия
Плотность твердого и расплавленного алюминия снижается по мере увеличения его чистоты: Плотность алюминия при 20°С
| Степень чистоты, % | 99,25 | 99,40 | 99,75 | 99.97 | 99,996 | 99.9998 |
| Плотность при 20°С, г/см3 | 2,727 | 2,706 | 2,703 | 2,6996 | 2,6989 | 2,69808 |
Плотность расплавленного алюминия при 1000°С
| Степень чистоты, % | 99,25 | 99.40 | 99.75 |
| Плотность, г/см3 | 2,311 | 2,291 | 2,289 |
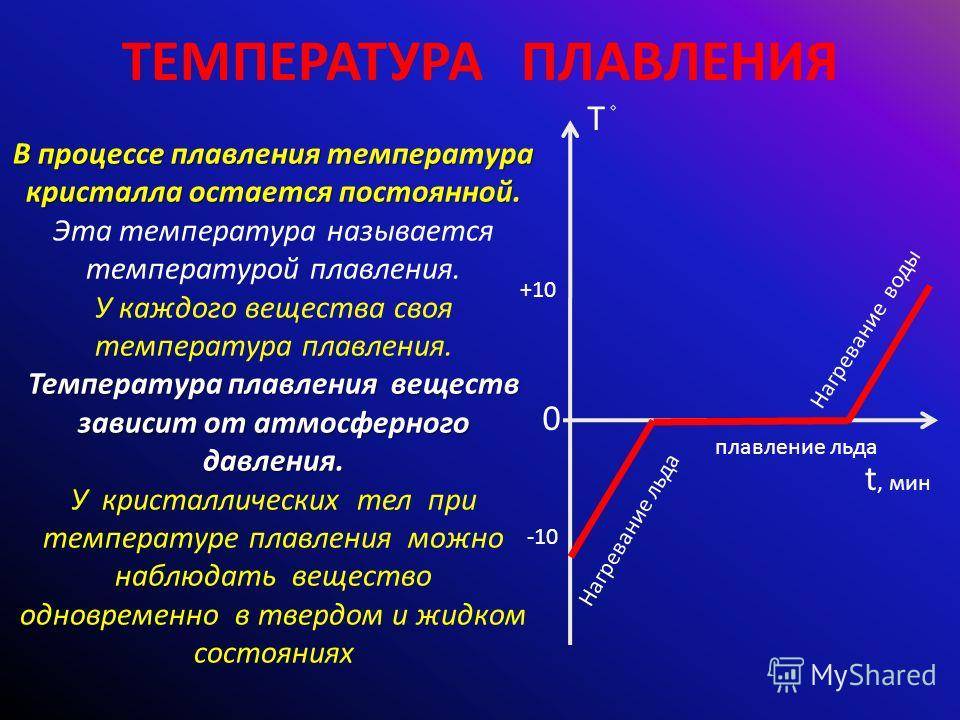
Температура плавления и кипения.
В момент плавления алюминия возрастает объем металла: для алюминия чистотой 99,65 % — на 6,25%, для более чистого металла — на 6,60 %. По мере повышения степени чистоты алюминия температура его плавления возрастает: Зависимисть температуры плавления алюминия от чистоты
| Степень чистоты, % | 99,2 | 99,5 | 99,6 | 99,97 | 99,996 |
| Температура плавления, °С | 657 | 658 | 659,7 | 659,8 | 660,24 |
Теплопроводность алюминия
Теплопроводность алюминия повышается с увеличением степени его чистоты. Для технического алюминия (99,49 и 99,70%) теплопроводность при 200°С равна соответственно 209 и 222 Вт/(м×К). Для электролитически рафинированного алюминия чистотой 99,9% теплопроводность при 190°С возрастает до 343 Вт/(м×К). Примеси меди, магния и марганца в алюминии снижают его теплопроводность. Например, добавка 2 % Mn к алюминию снижает теплопроводность с 209 до 126 Вт/(м×К).
Электропроводность алюминия
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота). Удельная электропроводность алюминия чистотой 99,99 % при 20°С равна 37,9 мкСм×м, что составляет 63,7% от электропроводности меди . Более чистый алюминий обладает электропроводностью, равной 65,9% от электропроводности меди. На электропроводность алюминия влияет ряд факторов: степень деформации, режим термической обработки и т. д., решающую же роль играет природа примесей, присутствующих в алюминии. Примеси по их отрицательному влиянию на электропроводность алюминия можно расположить в следующий ряд: Cr, V, Mn, Ti, Mg, Ag, Сu, Zn, Si, Fe Ni. Наиболее отрицательное влияние на электросопротивление алюминия оказывают примеси Сг, V, Мп и Ti . Поэтому в алюминии для электротехнической промышленности сумма Cr+V+Mn+Ti не должна превышать 0,015% (марка А5Е) и даже 0,01 % (А7Е) при содержании кремния соответственно 0,12 и 0,16 %.
Влияние примесей на электропроводность алюминия
Основными примесями в алюминии являются кремний, железо, медь, цинк и титан. При малых содержаниях кремния в алюминии (0,06%) величина Fe : Si (в пределах от 0,8 до 3,8) сравнительно мало влияет на его электросопротивление. При увеличении содержания кремния до 0,15—0,16% влияние Fe : Si возрастает. Ниже приведено влияние Fe : Si на электропроводность алюминия: Влияние Fe : Si на электропроводность алюминия
| Fe : Si | 1,07 | 1,44 | 2,00 | 2,68 | 3,56 |
| Удельное электросопротивление алюминия, ×10-2 мкОм·мм: | |||||
| нагартованного | 2,812 | 2,816 | 2,822 | 2,829 | 2,838 |
| отожженного | 2,769 | 2,771 | 2,778 | 2,783 | 2,788 |
Удельное электрическое сопротивление отожженной алюминиевой проволоки (ρ, мкОм·м) при 20°С в зависимости от содержания примесей можно приблизительно определить по следующей формуле: ρ=0,0264+0,007×(% Si)+0,0007×(% Fe) + 0,04×.
Отражательная способность
С повышением степени чистоты алюминия возрастает его способность отражать свет от поверхности. Так, степень отражения белого света от прокатанных алюминиевых листов (фольги) в зависимости от чистоты металла, возрастает следующим образом: для Аl 99,2%—75%, Аl 99,5%—84% и для Аl 99,8%—86%. Поверхность листа, изготовленного из электролитически рафинированного алюминия чистотой 99,996%, отражает 90% падающего на него белого света.
www.metmk.com.ua
Свойства сплавов металла
Показатель температурного градиента колеблется для соединений металла с другими химическими элементами, определяющими их свойства. Для литейных сплавов, содержащих магний и кремний, он составляет 500 °C.
Температура начала перехода в жидкое состояние называется точкой солидус (твердый), а окончание — ликвидус (жидкий). Соответственно начало кристаллизации будет определяться точкой ликвидус, а окончание — солидус. В температурном интервале соединение находится в переходном состоянии от жидкости к твердой фазе.
Например, соединению алюминия с 12,5% кремния, как и чистому металлу, свойственна точка плавления, а не интервал. Этот сплав относится к литейным и характеризуется постоянной температурой 577 °C.
При увеличении в сплаве количества кремния градиент ликвидус снижается от максимального показателя, свойственного чистому металлу. Среди лигатурных добавок температурный градиент снижает использование магния (450 °C). Для соединения с медью он составляет 548 °C, а с марганцем — всего 658 °C.
 Алюминий образует различные сплавы с минералами.
Алюминий образует различные сплавы с минералами.
Большинство соединений состоят из нескольких компонентов, что влияет на показатель затвердевания и плавления материала. Понятия температурных градиентов солидус и ликвидус определены для бесконечной длительности процессов равновесных переходов в жидкое и твердое состояние.
На практике учитываются поправки скорости нагревания и охлаждения составов.
Как был открыт
Бокситы и глинозем известны людям веками. С алюминием как металлом они познакомились только к середине XIX века.
Мировой опыт
История открытия – это опыты ученых-одиночек:
- Первую попытку предпринял Парацельс (XVI век). Он выделил из квасцов «квасцовую землю», содержащую оксид неизвестного металла (алюминия).
- Два века спустя процесс повторил немецкий химик Андреас Маргграф. Тоже получил оксид металла, которому присвоил название alumina («вяжущий»).
- Первые миллиграммы металла выделил датчанин Ганс Эрстед. Физик-практик выбрал исходником хлорид алюминия. Нагревая и воздействуя калийной амальгамой, получил чистый металл.
- Чистый калий, а не амальгаму использовал Фридрих Велер. Восстановив металл (получилось несколько крупинок), описал его свойства.
- Еще дальше пошел француз Сент-Клер Девиль. Он изготовил слиток металла, использовав метод Велера. Но вместо калия взял натрий. Девиль предъявил слиток публике на Всемирной выставке в Париже (1855 год), сотворив сенсацию. Спустя год получил металл методом электролиза. Такой успех объясним: ученого спонсировал сам Наполеон III, рассчитывавший приспособить металл для военных нужд.
Получение металла промышленными партиями – заслуга американца Чарльза Холла и француза Поля Эру. Независимо друг от друга они к 1886 году разработали методику расплава глинозема в криолите электролизом.
Металл в России
С глиноземом экспериментировали и русские ученые. Метод, предложенный К.И.Байером, стал классическим для алюминиевой промышленности мира.
Первый алюминиевый завод – Волховский – ввели в строй во времена СССР (1932 год).
Производство сырья исчислялось тысячами тонн. Эта отрасль была на особом счету: ее продукт обеспечивал обороноспособность государства.
Новое «золото»
Первый алюминий был дороже золота:
- Европейская знать использовала алюминиевые столовые приборы (гостям попроще выдавались серебряные или золотые). Моду задал своим указом император Франции Наполеон III.
- Ювелиры изготавливали украшения класса люкс.
- Бесценный подарок сделали англичане русскому гению Дмитрию Менделееву – весы с чашами из золота и алюминия.
Дешевый метод появился к началу ХХ века. В 1911 году во французском Дюрене выпустили первую партию металла. Его назвали в честь этого города. А алюминий перешел в разряд бижутерии.
– бокситы

Бокситы представляют собой смесь минералов, содержащую гидратированный глинозем и примеси; такие как оксиды железа и титана и диоксид кремния со следующими массовыми процентами:
-Для2ИЛИ3 35-60%
-Вера2ИЛИ3 10-30%
-Да2 4-10%
-Дядя2 2-5%
-ЧАС2Или конституции 12-30%.
Глинозем содержится в бокситах в гидратированной форме в двух вариантах:
-моногидраты (Al2ИЛИ3ЧАС2O), которые представлены двумя кристаллографическими формами, боэмитом и диаспором.
-Тригидраты (Al2ИЛИ33H2O), представленный гиббситом.
Бокситы являются основным источником алюминия и поставляют большую часть алюминия, получаемого при добыче полезных ископаемых.
Производство и рынок
Основная статья: Алюминиевая промышленность
Достоверных сведений о получении алюминия до XIX века нет. Встречающееся иногда со ссылкой на «Естественную историю» Плиния утверждение, что алюминий был известен при императоре Тиберии, основано на неверном толковании источника.
В 1825 году датский физик Ганс Христиан Эрстед получил несколько миллиграммов металлического алюминия, а в 1827 году Фридрих Вёлер смог выделить крупинки алюминия, которые, однако, на воздухе немедленно покрывались тончайшей плёнкой оксида алюминия.
До конца XIX века алюминий в промышленных масштабах не производился.
Только в 1854 году Анри Сент-Клер Девиль (его исследования финансировал Наполеон III, рассчитывая, что алюминий пригодится его армии) изобрёл первый способ промышленного производства алюминия, основанный на вытеснении алюминия металлическим натрием из двойного хлорида натрия и алюминия NaCl·AlCl3. В 1855 году был получен первый слиток металла массой 6—8 кг. За 36 лет применения, с 1855 по 1890 год, способом Сент-Клер Девиля было получено 200 тонн металлического алюминия. В 1856 году он же получил алюминий электролизом расплава хлорида натрия-алюминия.
В 1885 году был построен завод по производству алюминия в немецком городе Гмелингеме, работающий по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от способа Девиля, но была проще и заключалась во взаимодействии между криолитом (Na3AlF6) и магнием. За пять лет на этом заводе было получено около 58 т алюминия — более четверти всего мирового производства металла химическим путём в период с 1854 по 1890 год.
Метод, изобретённый почти одновременно Чарльзом Холлом в США и Полем Эру во Франции (1886 год) и основанный на получении алюминия электролизом глинозёма, растворённого в расплавленном криолите, положил начало современному способу производства алюминия. С тех пор, в связи с улучшением электротехники, производство алюминия совершенствовалось. Заметный вклад в развитие производства глинозёма внесли русские учёные К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др.
Первый алюминиевый завод в России был построен в 1932 году в городе Волхов. Металлургическая промышленность СССР в 1939 году производила 47,7 тыс. тонн алюминия, ещё 2,2 тыс. тонн импортировалось.
Вторая мировая война значительно стимулировала производство алюминия. Так, в 1939 году общемировое его производство, без учёта СССР, составляло 620 тыс. т, но уже к 1943 году выросло до 1,9 млн т.
К 1956 году в мире производилось 3,4 млн т первичного алюминия, в 1965 году — 5,4 млн т, в 1980 году — 16,1 млн т, в 1990 году — 18 млн т.
В 2007 году в мире было произведено 38 млн т первичного алюминия, а в 2008 — 39,7 млн т. Лидерами производства являлись:
- КНР (в 2007 году произвёл 12,60 млн т, а в 2008 — 13,50 млн т)
- Россия (3,96/4,20)
- Канада (3,09/3,10)
- США (2,55/2,64)
- Австралия (1,96/1,96)
- Бразилия (1,66/1,66)
- Индия (1,22/1,30)
- Норвегия (1,30/1,10)
- ОАЭ (0,89/0,92)
- Бахрейн (0,87/0,87)
- ЮАР (0,90/0,85)
- Исландия (0,40/0,79)
- Германия (0,55/0,59)
- Венесуэла (0,61/0,55)
- Мозамбик (0,56/0,55)
- Таджикистан (0,42/0,42)
В 2021 году было произведено 59 млн тонн алюминия
См. также: Список стран по выплавке алюминия
На мировом рынке запас составляет 2,224 млн т., а среднесуточное производство — 128,6 тыс. т. (2013.7).
В России монополистом по производству алюминия является , на которую приходится около 13 % мирового рынка алюминия и 16 % глинозёма.
Мировые запасы бокситов практически безграничны, то есть несоизмеримы с динамикой спроса. Существующие мощности могут производить до 44,3 млн т первичного алюминия в год. Следует также учитывать, что в будущем некоторые из применений алюминия могут быть переориентированы на использование, например, композитных материалов.
Цены на алюминий (на торгах международных сырьевых бирж) с 2007 по 2015 годы составляли в среднем 1253—3291 долларов США за тонну.
Типичные механические свойства деформируемых алюминиевых сплавов.
Типичные механические свойства деформируемых алюминиевых сплавов.
(044)490-04-88
Таблица из «Промышленные деформируемые, спеченные и литейные алюминиевые сплавы. Справочное руководство.» отв. ред. Ф. И. Квасов, И. Н. Фриляндер.
| Сплав и его состояние | Вид полуфабриката | E | σ0,2 | σв | δ | ψ | τcp | HB | σ-1 |
| (кгс/мм2) | % | (кгс/мм2) | |||||||
| ¹ знакопеременный изгиб на базе 5×108 циклов, остальные — на базе 2×107 циклов | |||||||||
| Алюминиевые сплавы низкой и средней прочности | |||||||||
| АДМ | Прессованные и катанные | 7100 | 3 | 8 | 35 | 80 | 5,5 | 25 | 3,5¹ |
| АД1Н | То же | 7100 | 15 | 10 | 6 | 60 | 7,0 | 32 | 5,5¹ |
| АМцМ | Катанные | 7100 | 5 | 13 | 23 | 70 | 8,0 | 30 | 5¹ |
| АМцП | 7100 | 13 | 18 | 10 | 55 | 10 | 40 | 6,5¹ | |
| АМцН | 7100 | 18 | 22 | 5 | 50 | 11 | 55 | 7¹ | |
| АМг1М | Прессованные и катанные | 6900 | 5,0 | 12 | 28 | – | 10 | 30 | 7¹ |
| АМг1Н | Катанные | 7000 | 19 | 21 | 5 | – | 12 | 55 | 9,5¹ |
| АМг2М | 7000 | 9 | 19 | 23 | 30 | 12,5 | 45 | 11¹ | |
| АМг2Н2 | 7000 | 21 | 25 | 8 | – | 14 | 68 | 12,5¹ | |
| АМг2Н | 7100 | 23 | 28 | 5 | – | 16,5 | 77 | 14¹ | |
| АМг3М | 7000 | 12 | 23,5 | 22 | – | 15,5 | 58 | 11,5 | |
| АМг3Н2 | 7000 | ≥23 | 27 | 8 | – | 16 | 75 | 13¹ | |
| АМг4М | 6900 | 14 | 27 | 23 | – | 16 | – | 13,5 | |
| АМг4Н2 | 6900 | 24 | 32 | 12 | – | 19 | – | – | |
| АМг5М | 6900 | 18 | 30 | 20 | – | 18 | 65 | 14 | |
| АМг5Н | 7000 | 32 | 42 | 10 | – | 22 | 100 | 15,5¹ | |
| АМг6М | 7000 | 17 | 34 | 20 | 25 | 21 | – | 13 | |
| АМг6Н | 7000 | 28 | 38 | 6 | – | – | – | – | |
| АД31Т | Прессованные | 7100 | 8 | 17 | 20 | – | – | – | 7,0¹ |
| АД31Т1 | 7100 | 20 | 24 | 10 | – | 16 | 80 | 9 | |
| АД33Т | 7100 | 14 | 24 | 20 | – | 16,5 | 65 | 10,5 | |
| АД33Т1 | 7100 | 27 | 31 | 12 | 25 | 19 | 95 | 11 | |
| АД35Т | 7100 | 18 | 27 | 15 | – | 15,5 | 60 | – | |
| АД35Т1 | 7100 | 28 | 33 | 8 | 35 | 18 | 95 | 11 | |
| АВТ1 | 7100 | 29 | 35 | 12 | 20 | 21 | 95 | 11,5 | |
| Алюминиевые сплавы средней прочности | |||||||||
| Сплав и его состояние | Вид полуфабриката | E | σ0,2 | σв | δ | ψ | τcp | HB | σ-1 |
| (кгс/мм2) | % | (кгс/мм2) | |||||||
| Д1Т | Штамповки | 7100 | 25 | 41 | 15 | 30 | 27 | 110 | 12,5¹ |
| Д16Т | Катанные | 6900 | 29 | 44 | 19 | – | 28 | 120 | 12,5 |
| Д16Т1 | 6900 | 40 | 45 | 7 | – | 27 | – | 12,5 | |
| Д16Т1Н | 6900 | 46 | 50 | 5,5 | – | 28,5 | – | 12,5 | |
| Д16Т | Прессованные | 7200 | 38 | 52 | 12 | 15 | 30 | 130 | 14¹ |
| Д19Т | Катанные | 6900 | 30 | 44 | 20 | – | – | – | |
| Д19ТН | 6900 | 36 | 48 | 13 | – | – | – | ||
| Д19Т | Прессованные | 7200 | 34 | 46 | 12 | – | 29 | 120 | |
| М40Т | Катанные | 7000 | 25 | 39 | 18 | – | – | – | |
| Прессованные | 7100 | 31 | 41 | 12 | 17 | – | – | ||
| ВАД1Т | Катанные | 6900 | 28 | 44 | 18 | – | – | – | 12 |
| Прессованные | 7200 | 36 | 50 | 13 | – | – | – | 14 | |
| Д20Т1 | Катанные | 6900 | 30 | 42 | 11 | 26 | 10,5¹ | ||
| Д29Т1Н | 6900 | 36 | 45 | 10 | 29 | 10,5¹ | |||
| Д20Т1 | Прессованные | 6900 | 28 | 42 | 10 | 35 | 27 | 100 | 13 |
| Д21Т1 | Поковки и штамповки | 7000 | 35 | 43 | 9 | 18 | |||
| 1201 | Катанные | 30 | 42 | 12 | |||||
| 1205 | Катанные | 40 | 50 | 9 | |||||
| ВД17Т1 | Штамповки: | 7200 | 34 | 52 | 17 | 20 | 115 | 16 | |
| продольное направление | |||||||||
| поперечное направление | 7200 | 30 | 44 | 17 | 20 | ||||
| В92Т1 | Катанные | 6900 | 30 | 40 | 10 | ||||
| Прессованные | 7000 | 34 | 45 | 10 | 11 | 15 | |||
| 1915Т1 | Катанные | 6800 | 28 | 36 | 11 | ||||
| Прессованные | 7000 | 32 | 38 | 10 | |||||
| 1420Т1 | Катанные | 7500 | 27 | 44 | 9 | ||||
| Прессованные | 7600 | 31 | 46 | 9 | 12 | ||||
| 1911Т1 | Катанные | 6800 | 35 | 42 | 12 | ||||
| Прессованные | 7000 | 42 | 50 | 15 |
«М-Комплект» 2007 — 2017 www.metmk.com.ua
Физические свойства
Алюминий не имеет каких-либо уникальных физических свойств, но их сочетание делает металл одним из самых широко востребованных.
Твердость чистого алюминия по шкале Мооса равняется трем, что значительно ниже, чем у большинства металлов. Данный факт является практически единственным препятствием для использования чистого металла.
Если внимательно рассмотреть таблицу физических свойств алюминия, то можно выделить такие качества, как:
- Малую плотность (2.7 г/см3);
- Высокую пластичность;
- Низкое удельное электрическое сопротивление (0,027 Ом·мм2/м);
- Высокую теплопроводность (203.5 Вт/(м·К));
- Высокую светоотражательная способность;
- Низкую температуру плавления (660°С).
Такие физические свойства алюминия, как высокая пластичность, низкая температура плавления, отличные литейные качества, позволяют использовать данный металл в чистом виде и в составе сплавов на его основе для производства изделий любой самой сложной конфигурации.
Вместе с этим, это один из немногих металлов, хрупкость которого не возрастает при охлаждении до сверхнизких температур. Данное свойство определило одну из областей применения в конструктивных элементах криогенной техники и аппаратуры.

Детали из алюминия
Существенно более высокую прочность, сравнимую с прочностью некоторых сортов стали, имеют сплавы на основе алюминия. Наибольшее распространение получили сплавы с добавлением магния, меди и марганца – дюралюминиевые сплавы и с добавлением кремния – силумины. Первая группа отличается высокой прочностью, а последняя одними из самых лучших литейных качеств.
Невысокая температура плавления снижает затраты на производство и себестоимость технологических процессов при производстве конструкционных материалов на основе алюминия и его сплавов.
Для изготовления зеркал используется такое качество, как высокий коэффициент отражения, сравнимый с показателем серебра, легкость и технологичность вакуумного напыления алюминиевых пленок на различные несущие поверхности (пластики, металл, стекло).
https://youtube.com/watch?v=IMf_Q5np_BM
При плавке алюминия и выполнения литья особое внимание обращается на способность расплава поглощать водород. Не оказывая действий на химическом уровне, водород способствует уменьшению плотности и прочности за счет образования микроскопических пор при застывании расплава
Благодаря низкой плотности и малому электрическому сопротивлению (ненамного выше меди), провода из чистого алюминия находят преимущественное применение при передаче электроэнергии в линиях электропередач, всего диапазона токов и напряжений в электротехнике, как альтернатива медным силовым и обмоточным проводам. Сопротивление меди несколько меньше, поэтому провода из алюминия необходимо использовать большего сечения, но итоговая масса изделия и его себестоимость оказываются в несколько раз меньше. Ограничением служит только несколько меньшая прочность алюминия и высокая сопротивляемость пайке из-за пленки окислов на поверхности. Большую роль играет наличие сильного электрохимического потенциала при контакте с таким металлом, как медь. В результате, в месте механического контакта меди и алюминия образуется прочная пленка окисла, имеющего высокое электрическое сопротивление. Это явление приводит к нагреву места соединения вплоть до расплавления проводников. Существуют жесткие ограничения и рекомендации по применению алюминия в электротехнике.

Алюминий в строительстве
Высокая пластичность позволяет изготавливать тонкую фольгу, которая используется в производстве конденсаторов высокой емкости.
Легкость алюминия и его сплавов стали основополагающими при использовании в авиакосмической отрасли при изготовлении большинства элементов конструкции летательных аппаратов: от несущих конструкций, до элементов обшивки, корпусов приборов и оборудования.
Числа окисления
Электронная конфигурация алюминия сразу указывает на то, что он способен потерять до трех электронов; то есть он имеет высокую тенденцию к образованию катиона Al3+. Когда предполагается наличие этого катиона в соединении, полученном из алюминия, говорят, что он имеет степень окисления +3; как известно, это самый распространенный для алюминия.
Однако существуют другие возможные, но редкие степени окисления для этого металла; например: -2 (Al2-), -1 (Al–), +1 (Al+) и +2 (Al2+).
В Аль2ИЛИ3, например, алюминий имеет степень окисления +3 (Al23+ИЛИ32-); а в AlI и AlO +1 (Al+F–) и +2 (Al2+ИЛИ2-) соответственно. Однако в нормальных условиях или ситуациях Al (III) или +3 является наиболее высокой степенью окисления; поскольку Al3+ Он изоэлектронен благородному газу неону.
Вот почему в школьных учебниках всегда предполагается, и не без оснований, что алюминий имеет +3 как единственное число или степень окисления.