Примечания и ссылки
- Иногда они написаны лантаноиды в связи с ИЮПАК по рекомендации для вызова этих элементов лантаноиды на английском языке для того , чтобы избежать путаницы с минеральными анионами , которые на английском языке имеют суффикс -ide : фторид для ионов фторида F – , хлорид для ионов хлора Cl – , галогенид для галогенида , сульфида для сульфида и т. д. В английском языке эта рекомендация мало соблюдается, во французском она тем более, тем более что в нашем языке не существует путаницы с минеральными анионами.
- (in) , раздел 1: Основные константы, единицы и коэффициенты преобразования , подраздел: Электронная конфигурация нейтральных атомов в основном состоянии , 84- е онлайн-издание, CRC Press, Бока-Ратон, Флорида, 2003.
- (in) Родерик П. Макдональд , Использование фильтра из оксида гольмия в спектрофотометрии , Clinical Chemistry , Vol. 10, декабрь 1964, стр. 1117-1120
- (in) Альберт К. Левин и Фрэнк С. Палилла , Новый высокоэффективный катодолюминесцентный люминофор с красным светом (YVO 4: Eu) для цветного телевидения » , Applied Physics Letters , vol. 5, п о 6,15 сентября 1964 г., стр. 118-120
- (in) Мэтью Р. Макдональд, Джефферсон Э. Бейтс, Джозеф В. Циллер, Филипп Фурче и Уильям Дж. Эванс , Завершение серии двух ионов лантаноидов для элементов: синтез молекулярных комплексов Pr 2+ , Gd2 +., Tb 2+ и Lu 2+ » , Журнал Американского химического общества , т. 135, п о 26,3 июля 2013 г., стр. 9857-9868
Сокращение лантаноидов
→ Основная статья : Сокращение лантаноидов
Из-за сжатия лантаноидов атомный радиус почти непрерывно уменьшается в диапазоне от церия (183 мкм) до лютеция (172 мкм) (исключение составляют европий и иттербий). Это связано с тем, что элементы, которые – в зависимости от атомного номера – находятся перед лантаноидами, уже заполнили электронами оболочки 6s и 5p, но не оболочку 4f. Теперь лантаноиды заполняют 4f-оболочку электронами. В упрощенном представлении атома как состоящего из пространственно разделенных электронных оболочек, электронная оболочка, пространственно более близкая к ядру, теперь заполнена носителями заряда. Вдобавок ядро, конечно, заполнено тем же числом протонов, что и электроны, добавленные к 4f-оболочке. В результате более сильное притяжение между электронами и протонами сокращает атомный радиус, в то время как атомный номер увеличивается.
Этот эффект на самом деле не является исключительным, поскольку радиус всегда уменьшается, когда чаша наполняется в течение определенного периода времени. Однако это свойство имеет некоторые последствия:
- Благодаря уменьшающимся размерам легко возможно разделение с помощью ионообменников .
- В гольмии радиус Ln 3+ настолько мал, что почти соответствует радиусу Y 3+ ; поэтому иттрий обычно встречается вместе с «тяжелыми землями».
- Внутри группы переходные элементы во 2-й и 3-й позициях имеют очень похожие свойства.
Лантан без лантаноидов
Как ни грустно сознавать, герой нашего рассказа — личность вполне заурядная. Это металл, обыкновенный по внешнему виду (серебристо-белый, покрытый сероватой окисной пленкой) и по физическим свойствам: температура плавления 920, кипения 3469° С; по прочности, твердости, электропроводности и прочим характеристикам металл лантан всегда оказывается в середине таблиц. Обыкновенен лантан и по химическим свойствам. В сухом воздухе он не изменяется — окисная пленка надежно защищает от окисления в массе. Но если воздух влажен (а в обычных земных условиях он влажен почти всегда), металлический лантан постепенно окисляется до гидроокиси. La(OH)3 — основание средней силы, что опять-таки характерно для металла-«середнячка».
церий
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Название с намеком: оно происходит от греческого A,av0dveiv — скрываться, забываться. Лантан, содержащийся в церите, успешно скрывался от химиков в течение 36 лет! Долгое время считали, что лантан двухвалентен, что он аналог кальция и других щелочноземельных металлов, а его атомный вес равен 90—94. В правильности этих цифр не сомневались до 1869 г. Менделеев же увидел, что во II группе периодической системы редкоземельным элементам нет места и поставил их в III группу, приписав лантану атомный вес 138—139. Но правомерность такого перемещения еще надо было доказать. Менделеев предпринял исследование теплоемкости лантана. Полученная им величина прямо указывала на то, что этот элемент должен быть трехвалентным… Металлический лантан, разумеется, далеко не чистый, впервые был получен Мозандером при нагревании хлористого лантана с калием. В наше время в промышленных масштабах получают лантан чистотой более 99%. Проследим, как это делается, но прежде познакомимся с главными минералами лантана и первыми стадиями сложнейшего процесса разделения редкоземельных элементов. Уже упоминалось, что в минералах лантан и лантаноиды неизменно сопутствуют друг другу. Есть минералы селективные, в которых доля того или иного редкоземельного элемента больше, чем обычно. Но нет минералов чисто лантановых или чисто цериевых, не говоря уже о других лантаноидах. Примером селективного лантанового минерала может служить давидит, в котором до 8,3% Lа203 и лишь 1,3% окиси церия. Но получают лантан преимущественно из монацита и бастнезита, как, впрочем, и церий, и все остальные элементы цериевой подгруппы. Монацит — тяжелый блестящий минерал, обычно желто-бурый, но иногда и других цветов, поскольку постоянством состава он не отличается. Точнее всего его состав описывает такая странная формула: (РЗЭ)Р04. Она означает, что монацит — фосфат редкоземельных элементов (РЗЭ). Обычно в монаците 50—68% окислов РЗЭ и 22—31,5% Ра05. А еще в нем до 7% двуокиси циркония, 10% (в среднем) двуокиси тория и 0,1—0,3% урана. Эти цифры со всей очевидностью показывают, почему так тесно переплелись пути редкоземельной и атомной промышленности. Смешанный металл редких земель — мишметалл — и смесь их окислов начали применять в конце прошлого века, а в начале нынешнего в связи с ними был /продемонстрирован выдающийся образец международного воровства. Немецкие суда, доставлявшие грузы в Бразилию, собираясь в обратный путь, заполняли трюмы песком с пляжей Атлантического побережья этой страны, причем из определенных мест. Капитаны заявляли, что песок — это просто балласт, необходимый для большей устойчивости судна. В действительности же они, выполняя заказы германских промышленников, крали ценное минеральное сырье — прибрежные пески штата Эспириту-Санту, богатые монацитом… Монацитовые россыпи распространены по берегам рек, озер и морей на всех континентах. В начале века (данные за 1909 г.) 92% мировой добычи редкоземельного сырья, и прежде всего монацита, приходилось на долю Бразилии. Спустя десять лет центр тяжести переместился на тысячи километров к востоку (или к западу, смотря как считать) — в Индию. После 1950 г. в связи с развитием атомной промышленности гегемоном среди капиталистических стран в добыче и переработке редкоземельного сырья стали Соединенные Штаты.
циркона432Кадмий3празеодима
К 1965 г. внешнеторговые организации нашей страны могли предложить покупателям все лантаноиды в виде металлов чистотой выше 99%. Кроме прометия, разумеется, хотя радиоактивные препараты этого элемента — продукты ядерного распада урана — тоже стали вполне доступны. В каталоги «Техснабэкспорта» вошли также около 300 химически чистых и особо чистых соединений лантана и лантаноидов. Это свидетельство высокого уровня развития советской редкоземельной промышленности. Но вернемся к лантану.
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях , которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно , чем кобальт , то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный , чем серебро , и туллий более обильный , чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса , согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.
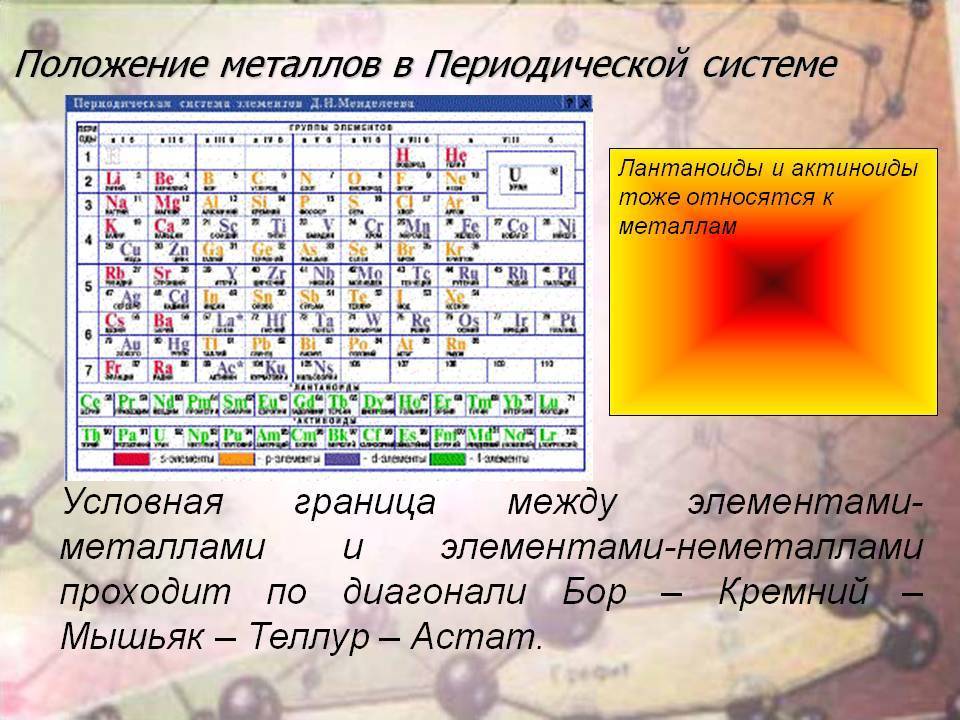
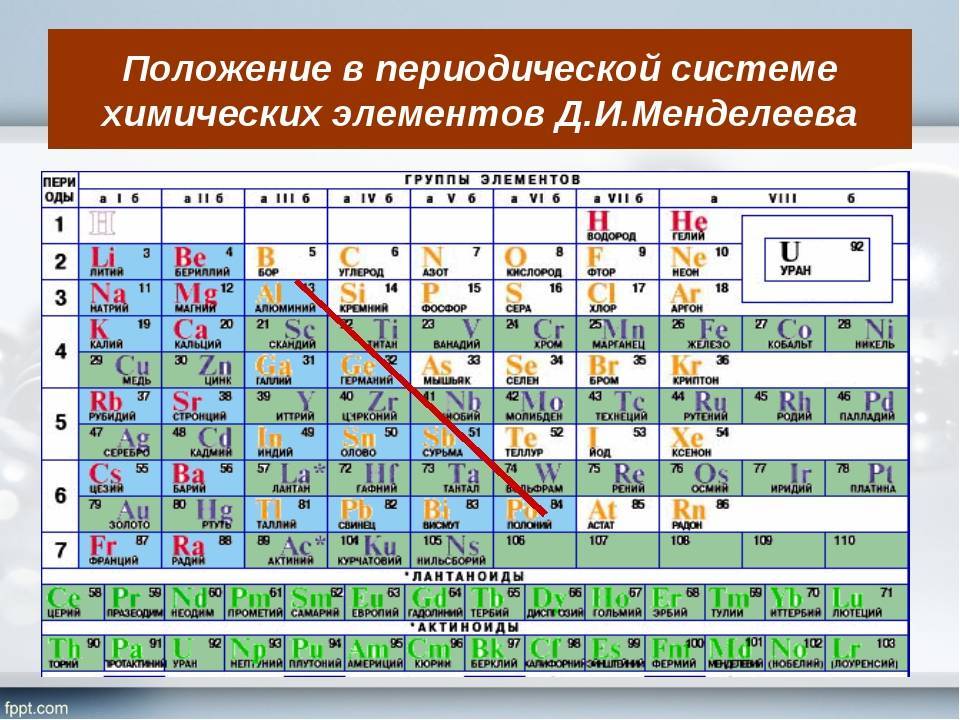
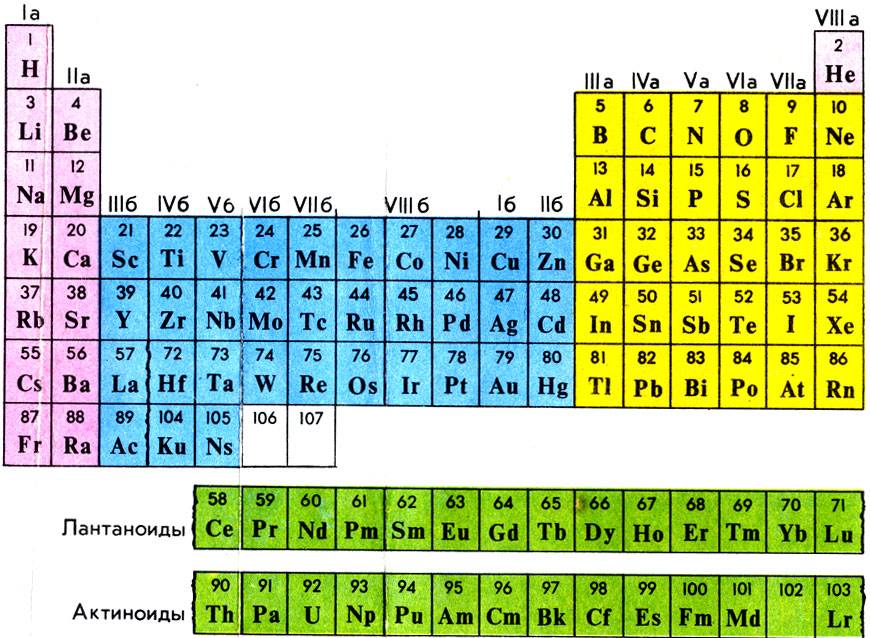
Как читать таблицу Дмитрия Ивановича Менделеева
Ячейки химической базы данных разбиты в группы последовательностей по горизонтали и вертикали. Элементы имеют краткое обозначение из 1-3 букв (для формул и вычислений).
Группы
Представлены в виде столбцов таблицы. В системе старого образца их 8.
В настоящий же момент выделено 18.
Распределяют элементы в группы по однотипности: по строению атома они подобны друг другу. Также у представителей одного столбца схожая формула высшего оксида.
Традиционные типы столбцов делятся на подкатегории: А (с яркими признаками группы) и В (переходные металлы). Принадлежность зависит от положения символа (слева для A или справа для B):
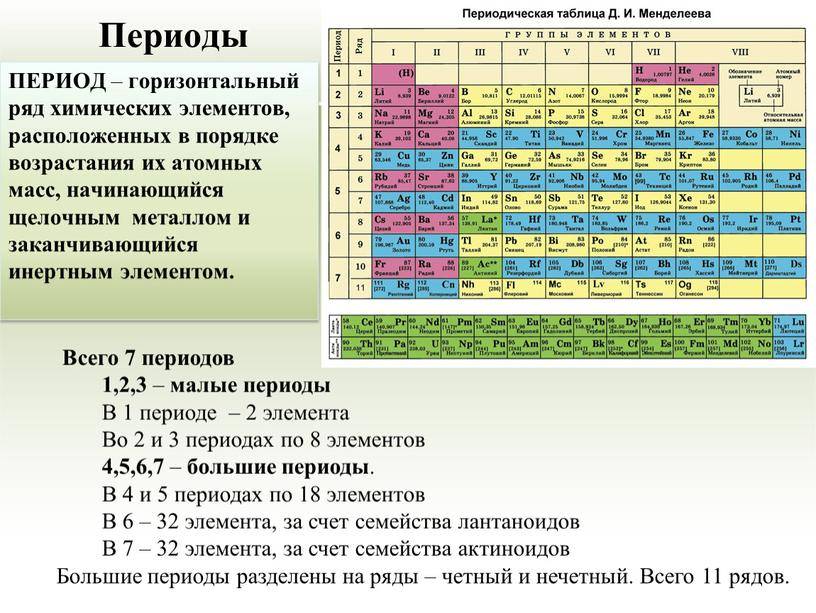
Периоды
Горизонтальные цепочки в таблице, в которых элементы расположены по росту порядкового номера. В линии слева направо увеличиваются заряды ядра атомов.
Периодов всего 7:
1-й период содержит лишь гелий He2 и водород H1;
2 и 3 содержат по 8 компонентов;
4-й и 5-й содержат 18 единиц каждый;
6-й период вмещает 32 элемента;
7-й хранит 31 единицу и продолжает дополняться.
Физический смысл порядкового номера
Порядковый номер химического элемента также показывает, сколько в составе ядра атома протонов и сколько электронов вращается вокруг него.
Общие свойства
Это блестящие металлы с серебристым блеском, которые быстро тускнеют на воздухе. По мере увеличения атомного номера они становятся все менее и менее мягкими . Их температура плавления и кипения выше, чем у большинства металлов, за исключением переходных металлов . Они бурно реагируют с большинством неметаллов и горят на воздухе. Это свойство используется в более легких камнях , которые сделаны из сплава лантаноидов, мишметалла .
Эти элементы не редкость в естественной среде, церий 58 Ce является 26- м или 27- м наиболее распространенным элементом земной коры (содержание того же порядка, что и у меди ). Неодима 60 Nd более многочисленно , чем кобальт , то лютеций 71 Л (менее обильные нерадиоактивные лантаноиды), однако, более обильный , чем серебро , и туллий более обильный , чем йод .
Лантаноиды довольно хорошо подтверждают эффект Оддо-Харкинса , согласно которому элементы с атомным номером больше 4 более распространены во Вселенной, когда их атомный номер четный, чем когда он нечетный.
Элемент Атомная масса Плавление температура Температура кипения массовый объем Атомный радиус Электронная конфигурация Энергия ионизации Электроотрицательность ( Полинг ) Ионный радиус трикации Ln 3+ Лантан 138,90547 ед. 920 ° С 3464 ° С 6,162 г · см -3 187 вечера 6s 2 5d 1 (*) 538,1 кДж · моль -1 1,10 103.2 вечера Церий 140,116 (1) ед. 795 ° С 3443 ° С 6,770 г · см -3 181,8 вечера 6s 2 4f 1 5d 1 (*) 534,4 кДж · моль -1 1,12 102 вечера Празеодим 140.90766 u 935 ° С 3 130 ° С 6,77 г · см -3 182 вечера 6s 2 4f 3 527 кДж · моль -1 1.13 99 вечера Неодим 144 242 (3) u 1,024 ° С 3074 ° С 7,01 г · см -3 181 вечера 6s 2 4f 4 533,1 кДж · моль -1 1.14 98.3 вечера Прометий 1042 ° С 3000 ° С 7,26 г · см -3 183 вечера 6s 2 4f 5 540 кДж · моль -1 1.13 97 вечера Самарий 150,36 (2) ед. 1072 ° С 1900 ° С 7,52 г · см -3 180 вечера 6s 2 4f 6 544,5 кДж · моль -1 1.17 95,8 вечера Европий 151 964 (1) ед. 826 ° С 1529 ° С 5,264 г · см -3 180 вечера 6s 2 4f 7 547,1 кДж · моль -1 1.2 94.7 вечера Гадолиний 157,25 (3) ед. 1312 ° С 3000 ° С 7,90 г · см -3 180 вечера 6s 2 4f 7 5d 1 (*) 593,4 кДж · моль -1 1,20 93.8 вечера Тербий 158.92 535 ед. 1,356 ° С 3,123 ° С 8,23 г · см -3 177 вечера 6s 2 4f 9 565,8 кДж · моль -1 1.2 92.3 вечера Диспрозий 162 500 (1) ед. 1,407 ° С 2,562 ° С 8,540 г · см -3 178 вечера 6s 2 4f 10 573,0 кДж · моль -1 1,22 91.2 вечера Гольмий 164.93033 ед. 1461 ° С 2600 ° С 8,79 г · см -3 176 вечера 6s 2 4f 11 581,0 кДж · моль -1 1,23 90,1 вечера Эрбий 167 259 (3) u 1529 ° С 2868 ° С 9,066 г · см -3 176 вечера 6s 2 4f 12 589,3 кДж · моль -1 1,24 89 вечера Тулий 168.93422 ед. 1545 ° С 1,950 ° С 9,32 г · см -3 176 вечера 6s 2 4f 13 596,7 кДж · моль -1 1,25 88 вечера Иттербий 173 045 ед. 824 ° С 1,196 ° С 6,90 г · см -3 176 вечера 6s 2 4f 14 603,4 кДж · моль -1 1.1 86,8 вечера Лютеций 174.9668 ед. 1,652 ° С 3,402 ° С 9,841 г · см -3 174 вечера 6s 2 4f 14 5d 1 523,5 кДж · моль -1 1,27 86,1 вечера
- (*) Исключения из правила Клечковского : лантан 57 La, церий 58 Ce, гадолиний 64 Gd.
§ 10. Периодический закон в свете теории строения атома
*Положение в периодической системе d- и f-элементов
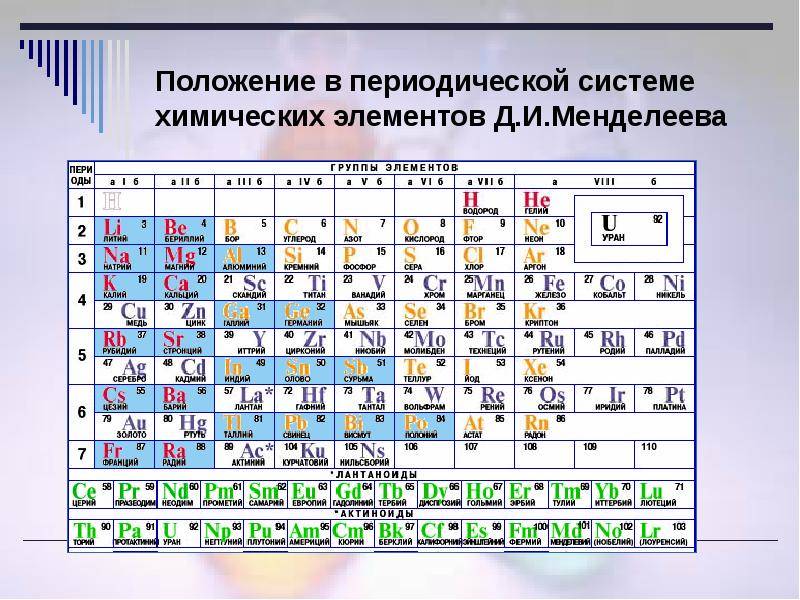
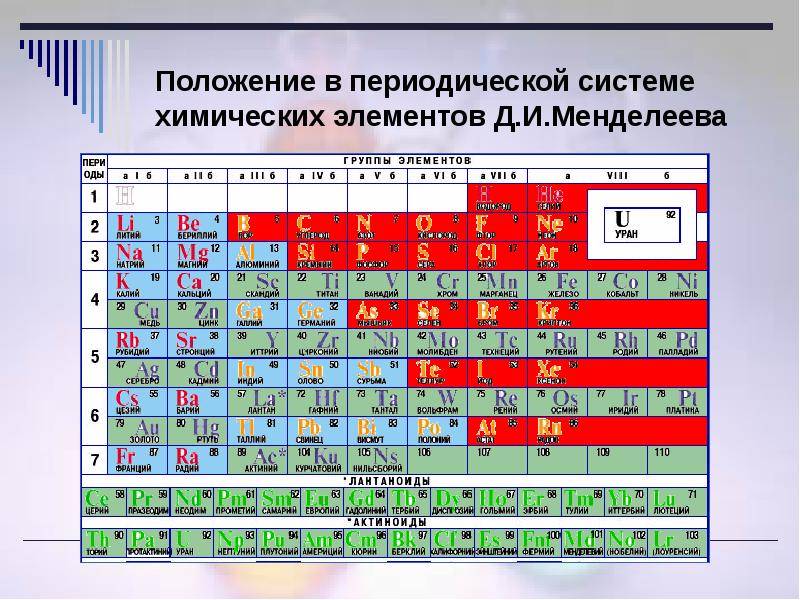
d– и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s– и p-элементами в 4–8-м периодах, их называют переходными.
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
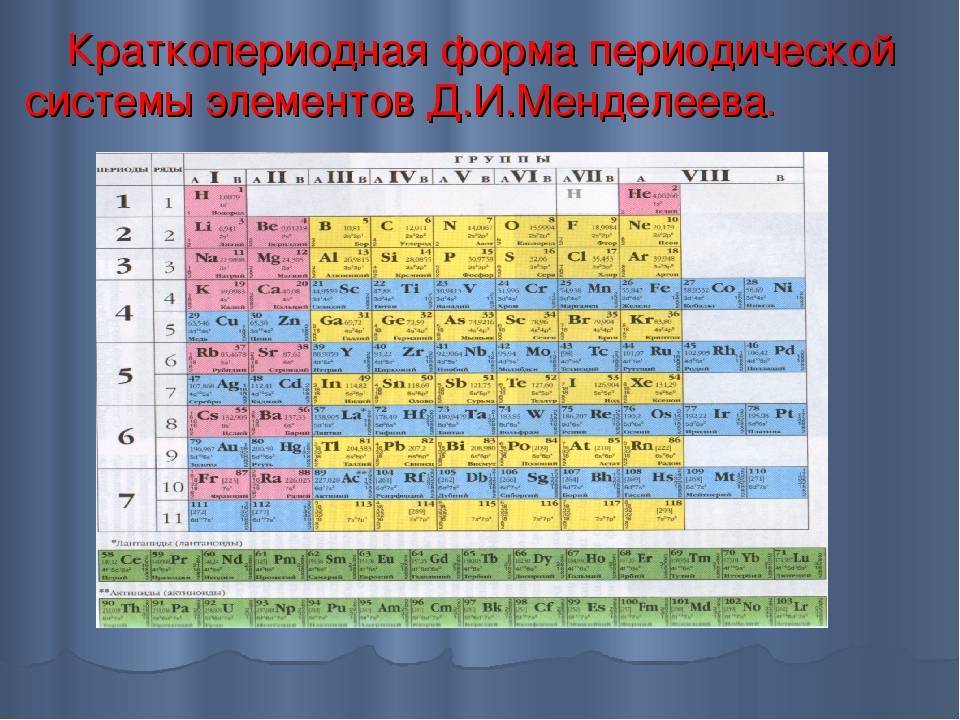
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s– и p-элементы, в побочных — d-элементы.
Рис. 20.1. Современный вариант короткопериодной периодической системы химических элементов
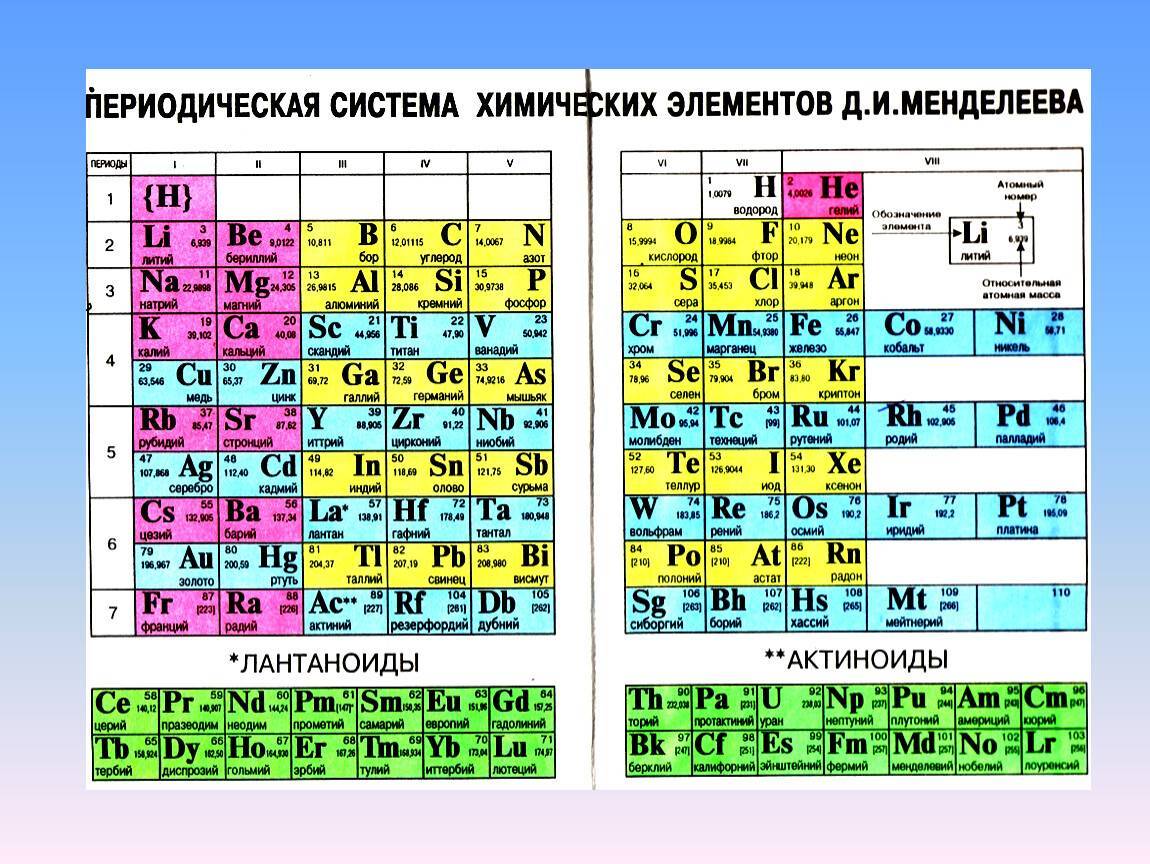
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
Рис. 20.2. Длиннопериодная форма периодической системы химических элементов
Элементы таблицы Менделеева

Также есть класс «металлоподобных» полупроводников с неопределенным статусом. Отдельно располагаются благородные газы, не подверженные реакциям.
Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Представители 1 (IA) и 2 (IIA) групп таблицы Менделеева – металлы со слабой устойчивостью и высокой степенью растворимости:
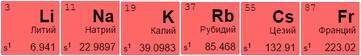
Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
2Na + 2H20 = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:

Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
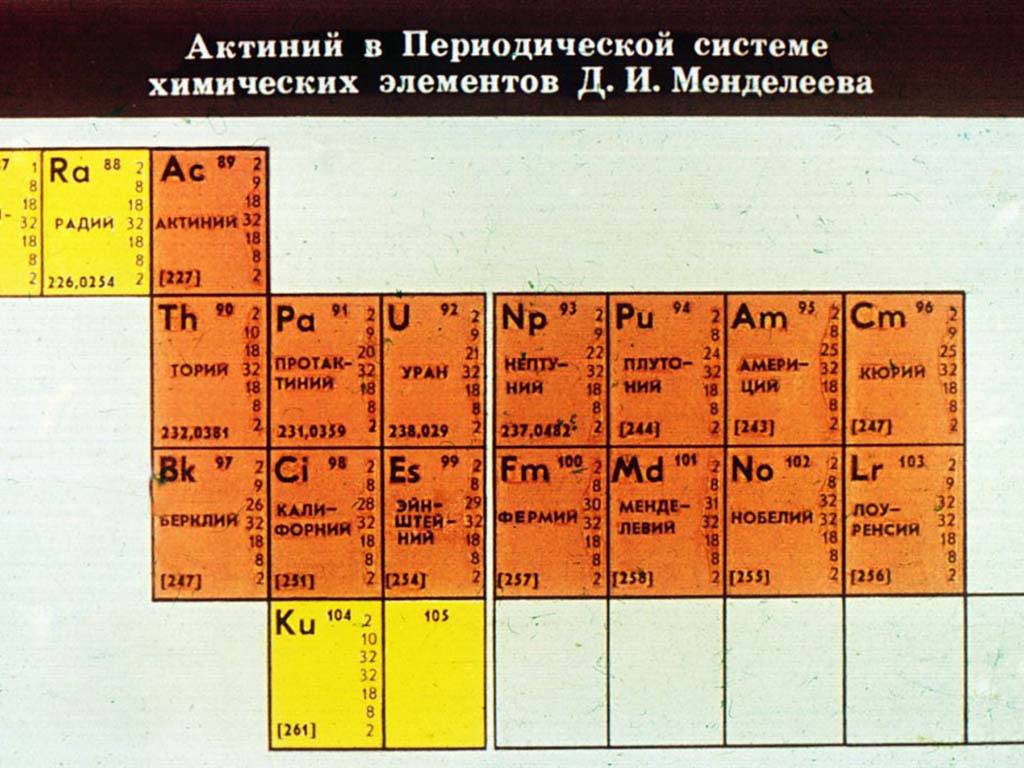
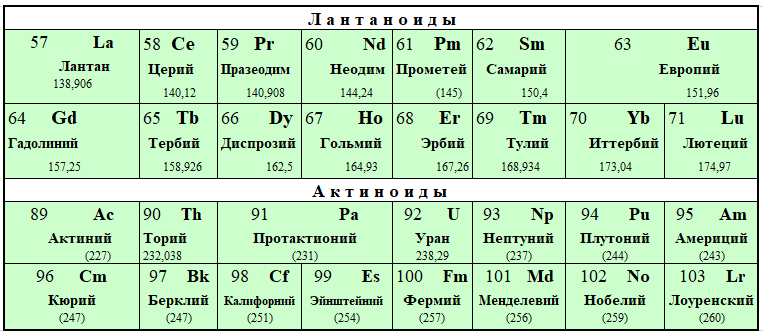
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.

В рамках семейства лантаноиды («скрытые») имеют схожую форму атома и внешние признаки, но различаются свойствами. Поодиночке почти не встречаются.
Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.

Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
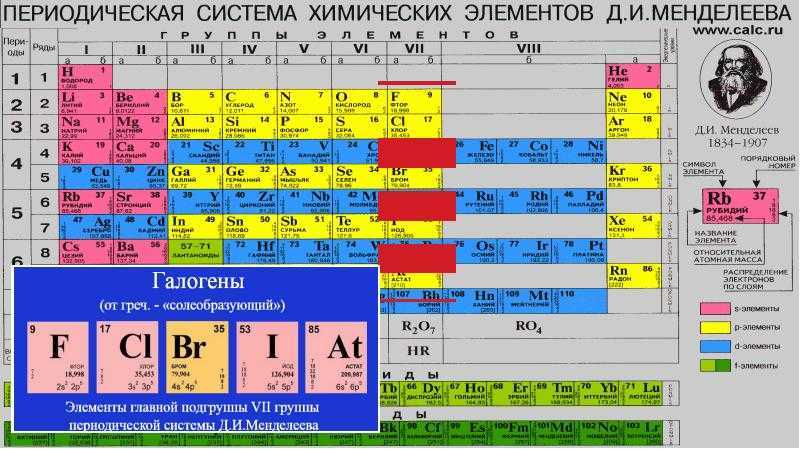
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:

В противоположность щелочам, эти неметаллы – самые сильные окислители, активно принимающие 8-й электрон к имеющимся семи для заполнения внешней оболочки.
Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
2F2
+ 2H2O = 4HF + O2
3F2
+ 3H2O = OF2 + 4HF + H2O2
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:

Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
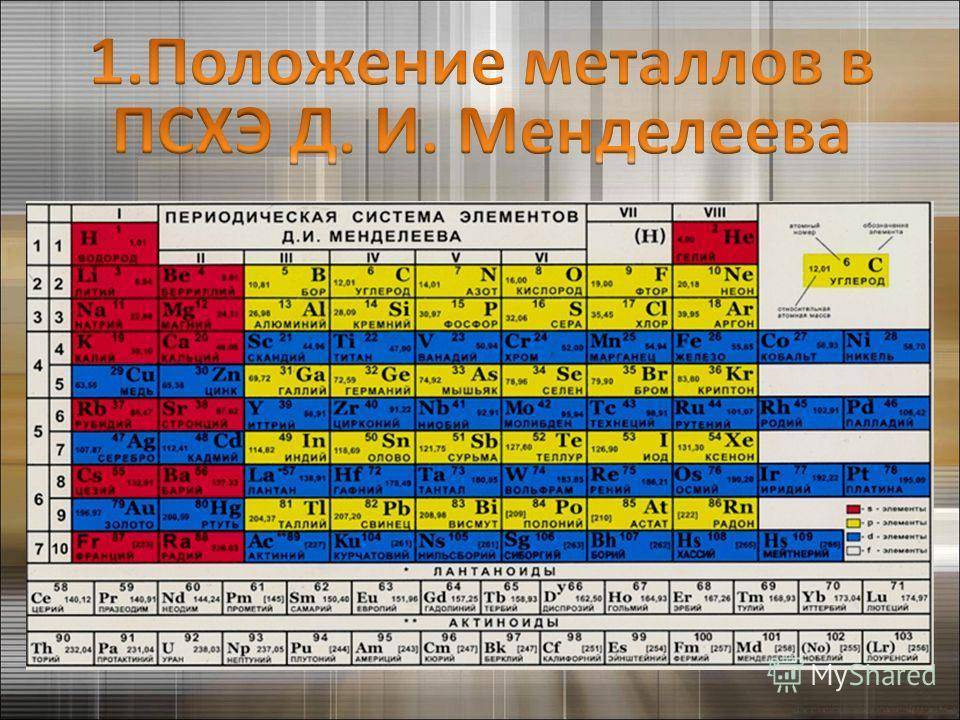
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
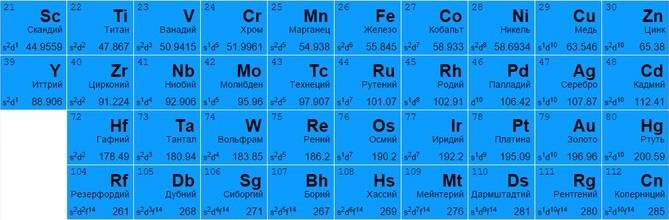
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
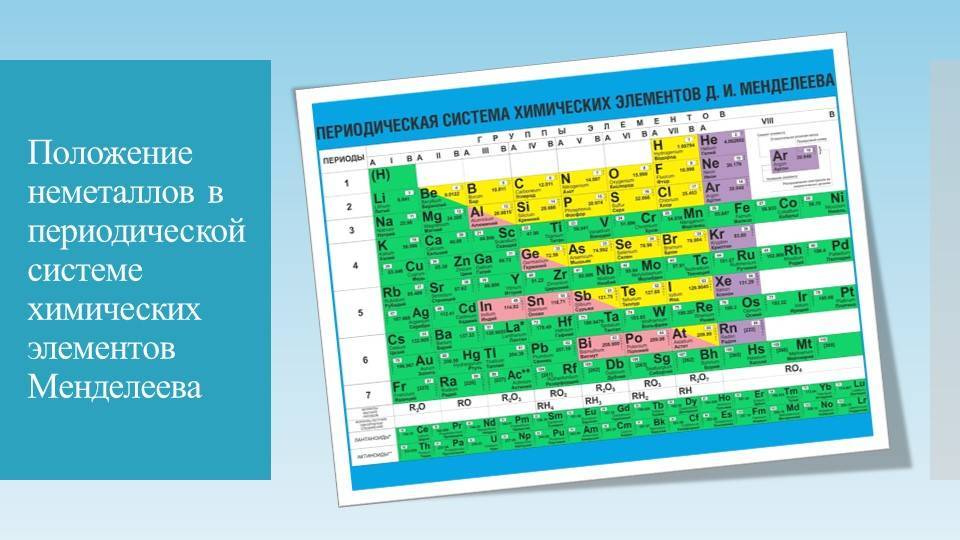
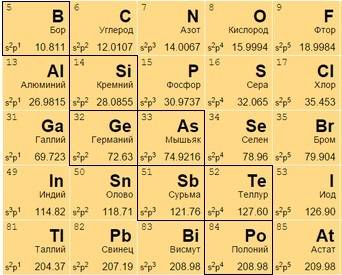
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
Они же «легкие». От переходных аналогов отличаются меньшей твердостью и весом. Имеют иные температуры плавления и кипения. Для соединений отдают электроны только с внешней оболочки. Превосходят полуметаллы по восстановительности. Легкий металл выглядит как вещество с матовым оттенком вместо блеска.

Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.

Могут находиться:
в виде газа (кислород O 8, азот N 7);
жидкости (бром Br 35);
в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Приложения
Каталитические компоненты используются, например, чтобы сделать сверхпроводники , редкоземельный самарий – кобальт и неодим – железо – бор магниты , катализаторы для переработки нефти , а также батареи аккумуляторов для гибридных электрических автомобилей . В катионы лантаноидов используются в качестве ионов активных материалов люминесцентного для применения оптоэлектронных , во- первых , чтобы сделать Nd: YAG лазеры . В оптических усилителях в волокне , легированные с эрбием являются важным компонентом волоконно – оптических систем связи. Фосфоресцирующие вещества на основе лантаноидов также широко используются для производства электронно-лучевых трубок , в частности для цветного телевидения . Сферы из железо-иттриевого граната ( ЖИГ ) могут использоваться в качестве регулируемых микроволновых резонаторов. Оксиды лантаноидов в смеси с вольфрамом улучшают свои термические свойства при сварке TIG , заменяя диоксид тория ThO 2., употребление которых представляет опасность для здоровья. Лантаноиды также используются во многих видах военной техники, таких как бинокли ночного видения и дальномеры . Радиолокационная система AN / SPY-1, установленная на некоторых зданиях с боевой системой Aegis и гибридными эсминцами силовой установки класса Arleigh Burke, использует редкоземельные магниты.
Лантаноиды также участвуют в таких областях, как фотокатализ («расщепление воды»), фотолюминесценция , создание современных материалов для электроники , а также в ядерной промышленности с разработкой матриц-хозяев для включения, хранения и переработки актинидов. .
Большая часть расходуемых ядов (поглотителей нейтронов), используемых в ядерных реакторах , обычно в оксидной форме, поступает из семейства лантаноидов , поскольку низкие изотопы нейтронов актинидов часто эффективны для захвата нейтронов . Это, например, случай европия , гадолиния , эрбия и диспрозия .