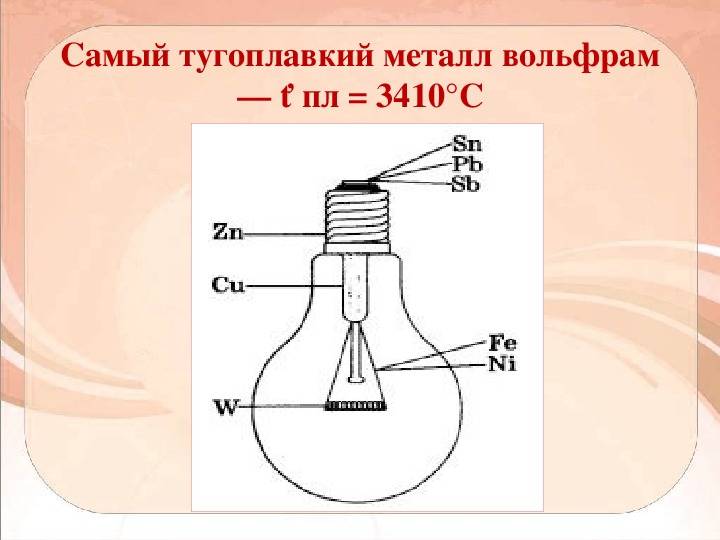
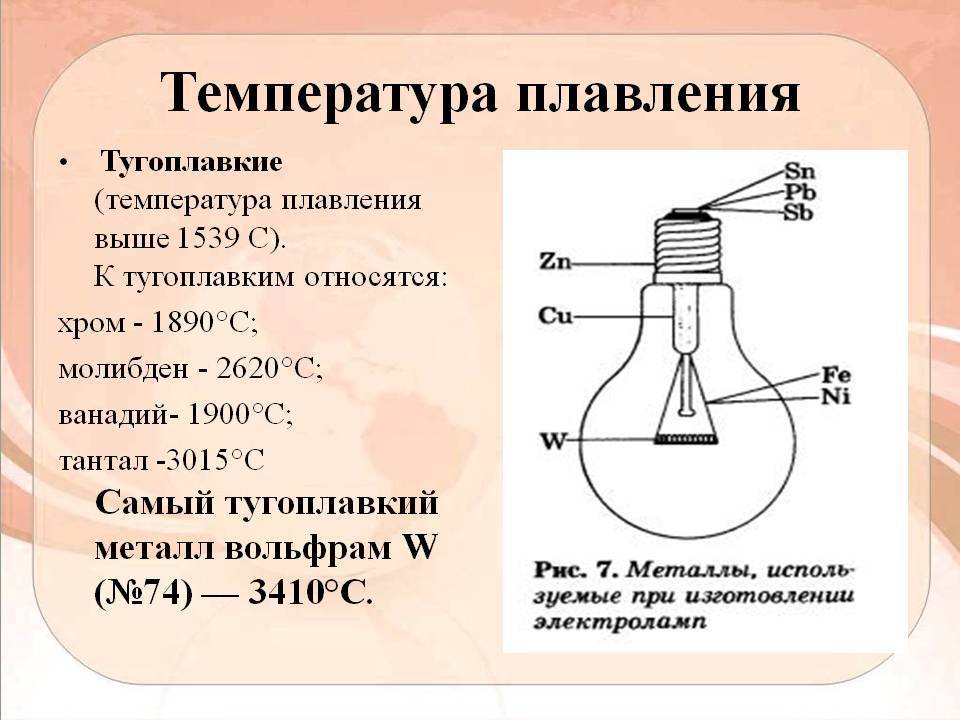
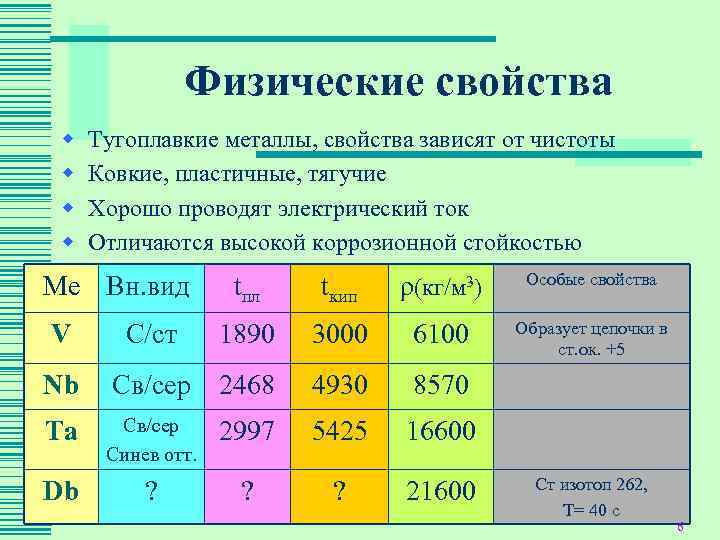
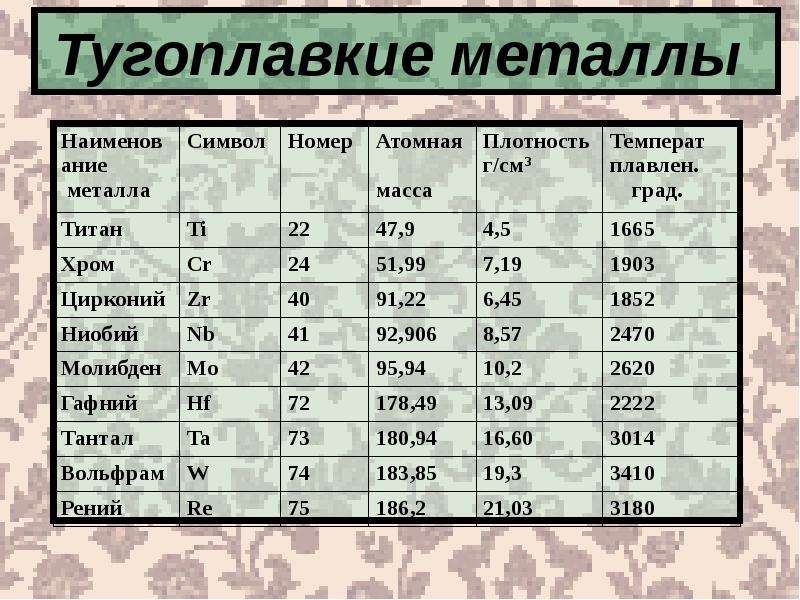
Температура плавления различных металлов
Согласно знаниям из раздела физики, процесс превращения твердого вещества в жидкое имеется лишь у тел с кристаллической решеткой. Температура плавления металлов и сплавов возникает в различном диапазоне значений. Но, с точностью высчитать пограничную температуру фазовых состояний у сплавов весьма проблематично. У чистых элементов имеет значимость каждый градус, если это составы с легкой плавкостью.
Железо
Температура плавления железных составов должна быть высокой. Если элемент обладает технической чистотой, то он плавится при температуре 1 539 °C. В составе его вещества присутствуют включения серы, поэтому для её извлечения необходимо жидкое состояние. Также очищенное железо получается в процессе электролиза солей металла.
Чугун
Чугун считается самым лучшим материалом для плавления. Он имеет хорошие показатели жидкой текучести и усадки, поэтому его эффективно использовать в процессе литья. Ниже будут приведены показатели температурного кипения чугуна:
Серая разновидность чугуна, у которой температурный режим доходит до отметки 1 260 °C. А при разливе его в формы, увеличивается до 1 400 °C.
Белая разновидность чугуна, у которого температура поднимается до 1 350 °C.
Одним из немаловажных моментов является то, что температура, которой обладает чугун, на 400 единиц меньше той же стали. Поэтому процесс обработки данного материала менее энергозатратен.
Сталь, температура плавления
Средняя температура плавления стали составляет 1400 °C.
Сталью называется железосодержащий сплав с включением углерода. Её основной характеристикой является прочность. Это достигается за счет того, что она долгое время сохраняет параметры объема и формы. При этом расположение молекул в веществе находится в сбалансированном состоянии. Именно поэтому достигается равновесие между силой притяжения и силой отталкивания.
Диапазон плавления стали выше, чем у чугуна, поэтому она более энергозатратна.
Нержавеющая сталь
Температура плавления нержавеющей стали колеблется в среднем диапазоне между чугуном и сталью. Нержавеющей сталью называется вещество из легированной стали, обладающее антикоррозийными свойствами за счет содержания хрома в своем составе от 11% процентов и больше.
Показатели температуры плавления нержавейки составляют от 1 300 до 15 000 °C.
Алюминий и медь
Температура плавления алюминия составляет 6 600 °C, поэтому он зарекомендовал себя в качестве одного из среднеплавких металлов. Плавление чистых медных составов происходит при температуре 10 830 °C, а сплавов – 930 — 11 400 °C.
Серебро и золото
Серебро в чистом виде плавится при температуре 9 620 °C. При этом при температуре плавления серебра, оно может сравниться с температурой плавления в градусах со сплавами из меди.
Золото плавится при температуре в 10 640 °C.
Сплавы на основе карбида вольфрама
Помимо значительной твердости, для указанных соединений характерна хрупкость и плохая обрабатываемость. В связи с этим чистый карбид вольфрама применяется редко в основном он входит в состав твердых сплавов, в которых еще содержатся кобальт, титан, тантал, но массовая доля карбида при этом остается наибольшей – 70–98%. Технические характеристики твердого сплава, содержащего 98% карбида вольфрама:
- предел прочности на изгиб — минимум 1 ГПа;
- модуль Юнга составляет 969 ГПа;
- предел прочности на сжатие — минимум 9,5 ГПа;
- плотность достигает 15000–15500 кг/м³;
- твердость по шкале Роквелла — минимум 90;
- стойкость к эрозии составляет 0,3–0,8 мкмоль.

Изделия из сплавов карбида вольфрама обладают особой прочностью
Химические свойства[ | ]
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот:
Реагирует с расплавленными щелочами в присутствии окислителей:
2 W + 4 N a O H + 3 O 2 ⟶ 2 N a 2 W O 4 + 2 H 2 O {\displaystyle {\mathsf {2W+4NaOH+3O_{2}\longrightarrow 2Na_{2}WO_{4}+2H_{2}O}}} W + 2 N a O H + 3 N a N O 3 ⟶ N a 2 W O 4 + 3 N a N O 2 + H 2 O {\displaystyle {\mathsf {W+2NaOH+3NaNO_{3}\longrightarrow Na_{2}WO_{4}+3NaNO_{2}+H_{2}O}}}
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Для дополнительного чтения
- Levitin, Valim. High Temperature Strain of Metals and Alloys: Physical Fundamentals. — WILEY-VCH, 2006. — ISBN 978-3-527-31338-9.
- Brunner, T. Chemical and structural analyses of aerosol and fly-ash particles from fixed-bed biomass combustion plants by electron microscopy, 1st World Conference on Biomass for Energy and Industry: proceedings of the conference held in Sevilla, Spain, 5–9 June 2000, London: James & James Ltd (2000). Дата обращения 26 сентября 2010.
- Donald Spink. Reactive Metals. Zirconium, Hafnium, and Titanium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 97—104. — DOI:10.1021/ie50614a019.
- Earl Hayes. Chromium and Vanadium // Журнал Industrial & Engineering Chemistry. — 1961. — Вып. 53. — № 2. — С. 105—107. — DOI:10.1021/ie50614a020.
Основные характеристики
Как самый тугоплавкий металл, вольфрам имеет специфические свойства:
- Температура плавления вольфрама — примерно соответствует температуре солнечной короны — 3422 °С.
- Вместе с этим, плотность чистого вольфрама ставит его в один ряд с наиболее плотными металлами. Его плотность практически равна плотности золота — 19,25 г/см3.
- Теплопроводность вольфрама зависит от температуры и составляет от 0,31 кал/см·сек·°С при 20°С до 0,26 кал/см·сек·°С при 1300°С.
- Теплоемкость также близка к золоту и составляет 0.15·103 Дж/(кг·К).
Металл имеет кубическую объемноцентрированную кристаллическую решетку. Несмотря на высокую твердость, вольфрам в нагретом состоянии очень пластичен и ковок, что позволяет изготавливать из него тонкую проволоку, имеющую широкое применение.
Вольфрамовая проволока
Имеет серебристо-серый цвет, который не меняется на открытом воздухе, поскольку вольфраму присуща высокая химическая стойкость, а с кислородом он реагирует только при температуре выше красного каления.
Химические свойства элемента, как правило, начинают проявляться при нагреве выше нескольких сотен градусов. В обычных условиях он не взаимодействует с большинством известных кислот, кроме смеси плавиковой и азотной кислот. В присутствии определенных окислителей может реагировать с расплавами щелочей. При этом для начала реакции требуется нагрев до температуры 400 — 500 °С, а далее реакция идет бурно, с выделением тепла.
Некоторые соединения, особенно карбид вольфрама, обладают очень высокой твердостью и находят применение в металлургическом производстве для обработки твердых сплавов.
Приведенные характеристики вольфрама определяют специфику областей применения металла, как в чистом виде, так и в составе различных сплавов и химических соединений. Вольфрам входит в состав многих жаростойких сплавов в качестве легирующей добавки для повышения твердости, температуры плавления и коррозионной стойкости. Близость плотности и теплоемкости вольфрама и золота теоретически может служить для подделки золотых слитков, однако это легко можно выявить при измерении электрического сопротивления и при переплавке золотого слитка.
Самый тугоплавкий металл на земле
Любознательных людей наверняка интересует вопрос, какой металл самый тугоплавкий? Прежде чем дать на него ответ, стоит разобраться с сами понятием тугоплавкости. Все известные науки металлы имеют разную температуру плавления в связи с различной степенью устойчивости связей между атомами в кристаллической решетке. Чем слабее эта связь, тем меньшая температура требуется, чтобы ее разорвать.
Самые тугоплавкие металлы в мире используются в чистом виде или в составе сплавов для производства деталей, которые работают в экстремальных термических условиях. Они позволяют эффективно противостоять высоким температурам и значительно продляют эксплуатационный период агрегатов. Но стойкость металлов данной группы к термическому воздействию заставляет металлургов прибегать к нестандартным методам их производства.
Какой металл самый тугоплавкий?
Самый тугоплавкий металл на Земле был открыт в 1781 году шведским ученым Карлом Вильгельмом Шееле. Новый материал получил название вольфрам. Шееле удалось синтезировать триокись вольфрама путем растворения руды в азотной кислоте.
Чистый металл был выделен двумя годами позже испанскими химиками Фаусто Фермином и Хуаном Хосе де Элюар. Новый элемент не сразу получил признание и был взят на вооружение промышленниками.
Дело в том, что технологии того времени не позволяли обрабатывать столь тугоплавкое вещество, поэтому большинство современников не придали особого значения научному открытию.
Вольфрам был оценен гораздо позже. На сегодняшний день его сплавы используются при производстве термостойких деталей для различных отраслей промышленности. Нить накаливания в газоразрядных бытовых лампах также изготавливается из вольфрама. Также он применяется в аэрокосмической промышленности для производства ракетных сопел, используется в качестве многоразовых электродов в газодуговой сварке. Кроме тугоплавкости вольфрам также обладает высокой плотностью, что позволяет использовать его для изготовления высококачественных клюшек для гольфа.
Общие свойства тугоплавких металлов
Тугоплавкие металлы и их сплавы привлекают внимание исследователей из-за их необычных свойств и будущих перспектив в применении. Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K
Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K
Физические свойства тугоплавких металлов, таких как молибден, тантал и вольфрам, их показатели твёрдости и стабильность при высоких температурах делает их используемым материалом для горячей металлообработки материалов как в вакууме, так и без него. Многие детали основаны на их уникальных свойствах: например, вольфрамовые нити накаливания способны выдерживать температуры вплоть до 3073 K.
Однако, их сопротивляемость к окислению вплоть до 500 °C делает их одним из главных недостатков этой группы. Контакт с воздухом может существенно повлиять на их высокотемпературные характеристики. Именно поэтому их используют в материалах, в которых они изолированы от кислорода (например лампочка).
Сплавы тугоплавких металлов — молибдена, тантала и вольфрама — применяются в деталях космических ядерных технологий. Эти компоненты были специально созданы в качестве материала способного выдержать высокие температуры (от 1350 K до 1900 K). Как было указано выше, они не должны контактировать с кислородом.
Температура перехода металлов в сверхпроводящее состояние
| Металл | °К |
|---|---|
| Титан | 0,53 |
| Ванадий | 5,1 |
| Цирконий | 0,7 |
| Ниобий | 9,17 |
| Молибден | 0,9-0,98 |
| Гафний | 0,35 |
| Тантал | 4,40 |
| Рений | 1,7 |
| Вольфрам | 0,05 |
Таблица перевода чисел твердости
| Твердость по Роквеллу | Твердость по Виккерсу (HV) | Твердость по Бринелю (HB) | |
|---|---|---|---|
| По шкале С (HRC) | По шкале А (HRA) | ||
| 70 | 86,5 | 1076 | — |
| 69 | 86,0 | 1004 | — |
| 68 | 85,5 | 942 | — |
| 67 | 85,0 | 894 | — |
| 66 | 84,5 | 854 | — |
| 65 | 84,0 | 820 | — |
| 64 | 83,5 | 769 | — |
| 63 | 83,0 | 763 | — |
| 62 | 82,5 | 739 | — |
| 61 | 81,5 | 715 | — |
| 60 | 81,0 | 695 | — |
| 50 | 76,0 | 513 | — |
| 49 | 75,5 | 498 | — |
| 48 | 74,5 | 485 | — |
| 47 | 74,0 | 471 | 448 |
| 46 | 73,5 | 458 | 437 |
| 45 | 73,0 | 446 | 425 |
| 44 | 72,5 | 435 | 415 |
| 42 | 71,5 | 413 | 393 |
| 40 | 70,5 | 393 | 372 |
| 30 | — | 301 | 283 |
| 28 | — | 285 | 270 |
| 26 | — | 271 | 260 |
| 24 | — | 257 | 250 |
| 22 | — | 246 | 240 |
| 20 | — | 236 | 230 |
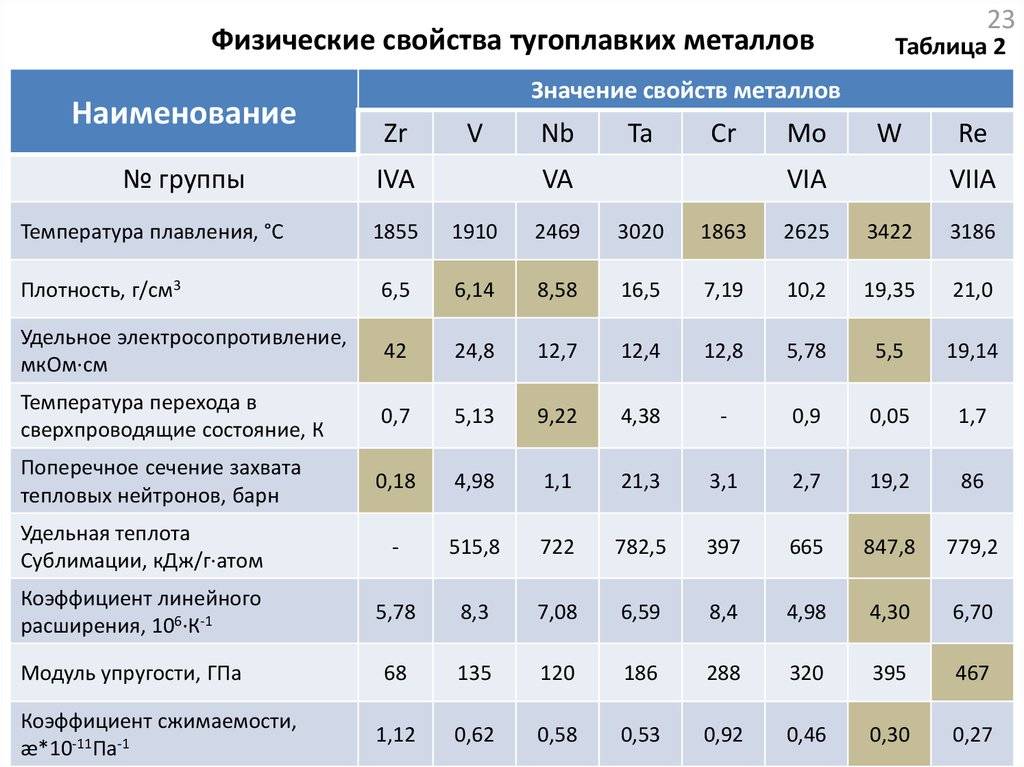
Упругие свойства тугоплавких металлов
| Металл | Коэффициент сжимаемости, Х106 см2/кГ | Модуль нормальной упругости, кГ/мм2 | Модуль сдвига, кГ/мм2 | Коэффициент Пуассона |
|---|---|---|---|---|
| Титан | — | 9000-10000 | — | — |
| Цирконий | 1,097 | 8960 | 3330 | 0,35 |
| Гафний | — | 9800-14060 | — | — |
| Ванадий | — | 13500 | — | — |
| Ниобий | — | 9080 | 8820 | 0,39 |
| Тантал | 0,52 | 18830 | 7000 | 0,35 |
| Хром | — | 25000 | — | — |
| Молибден | 0,347 | 33630 | 12200 | 0,31 |
| Вольфрам | 0,293 | 41500 | 15140 | 0,30 |
| Рений | — | 47000 | — | — |
| Рутений | — | 42000 | — | — |
| Родий | — | 28640 | — | — |
| Осмий | — | 57000 | — | — |
| Иридий | — | 53830 | — | — |
Коэффициент теплопроводности тугоплавких металлов
| Элемент | T °C | Коэффициент теплопроводности k Вт/м∙К |
|---|---|---|
| Ванадий | 20 | 33,2 |
| Вольфрам | 27 | 130 |
| Молибден | 27 | 162 |
| Ниобий | 27 | 53 |
| Тантал | 27 | 63 |
| Хром | 27 | 67 |
| Цирконий | 50 | 20,96 |
Термодинамические свойства тугоплавких металлов
| Элемент | Удельная теплоемкость, Дж/К∙моль | Теплота плавления, кДж/моль | Теплота испарения, кДж/моль |
|---|---|---|---|
| Ванадий | 0,485 | 17,5 | 460 |
| Вольфрам | 24,8 | 35 | 824 |
| Молибден | 0,251 | 28 | 590 |
| Ниобий | 0,268 | 26,8 | 680 |
| Тантал | 0,140 | 24,7 | 758 |
| Хром | 0,488 | 21 | 342 |
| Цирконий | 0,281 | 19,2 | 567 |
Обозначение символов:
- σв — предел прочности;
- σт— предел текучести;
- σ0,2 — предел текучести при котором остаточные деформации составляют 0,2 % от длины испытываемого образца;
- δ — относительное удлинение;
- ψ — относительное сужение;
- k — коэффициент теплопроводности;
- HB — твердость по Бринеллю;
- HV — твердость по Виккерсу;
- HR — твердость по Роквеллу.
Самый твердый металл
Самым твердым и при этом легким металлом на нашей планете считается титан. Благодаря своим свойствам, он активно используется в авиации и кораблестроении — материал отлично подходит для изготовления корпусов самолетов и кораблей. К тому же, благодаря прочности и легкости, из титана изготавливают бронежилеты. Этот металл безопасен для человеческого организма, поэтому часто применяется в медицине для изготовления инструментов и даже протезов — искусственных частей тела.
Благодаря выдающимся свойствам, словом «титан» называют видеокарты и прочую электронику, чтобы подчеркнуть их мощность
При нагревании, титан начинает поглощать кислород, хлор, азот и другие газы. Благодаря этому удивительному свойству, металл используется в различных фильтрах — пропуская различные газы через нагретые до 600 градусов Цельсия титановые трубки, можно очистить их от примесей. Таким же образом можно очистить воду от кислорода, что особенно полезно в пищевой промышленности. Считается, что содержащийся в воде кислород ухудшает качество некоторых продуктов — как минимум, он может сократить срок годности пива.
Технологии производства
Высокие температуры плавления предопределяют порошковую металлургию основным способом получения конечной продукции.
Обычно вопрос о том, какие металлы – тугоплавкие, решается тем, к какой из трёх категорий они относятся:
- Твёрдые сплавы;
- Оксидные или карбидные дисперсно-упрочненные материалы;
- Материалы с легированными свойствами.
Так, все продукты на основе вольфрама и большая часть молибденовых продуктов перерабатываются с помощью порошковой металлургии, поскольку из-за высокой температуры плавления, они не могут быть произведены методом распыления. Таким образом, процессы химического восстановления и электролиз – единственные практические методы.
Порошки, полученные электролитическим способом из водных электролитов или в расплавленном состоянии, имеют высокую чистоту и активны во время спекания. Однако у них есть следующие недостатки:
- Для удаления из электролита остаточных примесей необходима очистка;
- Процесс часто является дорогостоящим, потребляя много электроэнергии из-за низкого КПД по току;
- Процесс ограничен производством чистых металлических порошков, так как этим методом невозможно производить порошки сплавов.
Восстановителями, используемыми в большинстве процессов, являются углерод и водород – в их элементарной форме, либо в виде газообразных соединений или смесей (углеводородов, крекинг-аммиака или монооксида углерода).
Ещё недавно для производства молибдена и его сплавы применялось вакуумное литьё, однако в современных производствах и здесь используется порошковая металлургия. Эффективность восстановления металлического порошка зависит от:
- Требуемой энергии активации;
- Химического состава и степени дисперсности металлопорошка;
- Скорости потока восстанавливающего газа – водорода.
Порошковая металлургия – единственный путь производства сплавов, компонентами которых являются тугоплавкие металлы, в том числе, и на уровне нанопорошков. Среди различных методов, исследуемых для производства тугоплавких наносплавов – традиционный путь реакции газ-твердое тело, реализация которого позволяет производить наноструктурированные порошки в значительных количествах и с широкими возможностями обеспечения качества.
Важно подчеркнуть, что высокотемпературные технологии порошковой металлургии позволяют изготавливать материалы по индивидуальному заказу. Правильно подобрав исходный материал, можно соответствующим образом контролировать состав конечного продукта.. Третий способ – использование 3D-печати
Это активно развивающаяся технология, которая идеально подходит для производства легких, высокостабильных компонентов из вольфрама, молибдена, ниобия, тантала и их сплавов со сложной геометрической структурой.
Третий способ – использование 3D-печати. Это активно развивающаяся технология, которая идеально подходит для производства легких, высокостабильных компонентов из вольфрама, молибдена, ниобия, тантала и их сплавов со сложной геометрической структурой.
Нанопорошки тугоплавких металлов получают следующими способами:
- Селективным лазерным спеканием.
- Селективным лазерным плавлением.
- Электронно-лучевым плавлением.
- Прямым осаждением.
- Быстрым прототипированием.
Самый тугоплавкий металл в мире — свойства, получение, применение
Определение «тугоплавкие металлы» не требует дополнительных пояснений в силу исчерпывающей информативности самого термина. Единственным нюансом остается пороговая температура плавления, после которой вещество можно считать тугоплавким.
Где применяется вольфрам?
Широко используют соединения вольфрама. Их применяют в машиностроительной и горнодобывающей промышленностях, для бурения скважин. Из данного металла благодаря его высокой прочности и твердости изготавливают детали двигателей летательных аппаратов, нити накаливания, артиллерийские снаряды, сверхскоростные роторы гироскопов, пули и т.д. Также вольфрам успешно применяется как электрод при аргонно-дуговой сварке. Не обходятся и такие отрасли промышленности без соединений вольфрама – текстильная, лакокрасочная.
Определение
Большинство определений термина тугоплавкие металлы
определяют их как металлы имеющие высокие температуры плавления. По этому определению, необходимо, чтобы металлы имели температуру плавления выше 4,000°F (2,200°C ). Это необходимо для их определения как тугоплавких металлов.
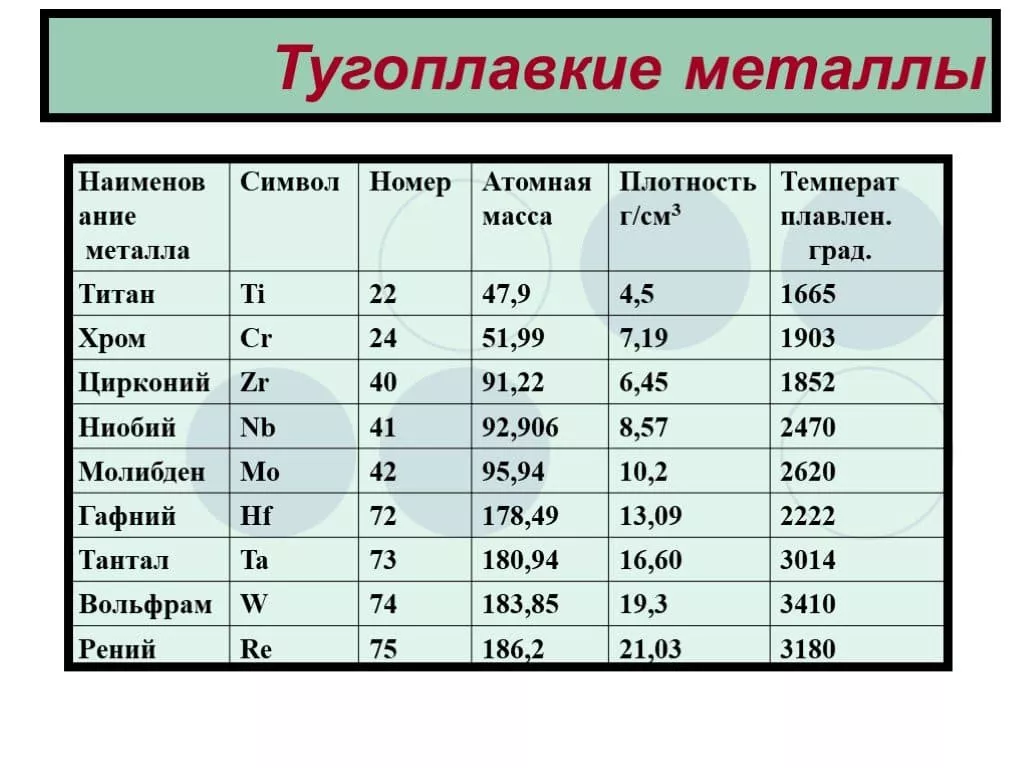
Пять элементов — ниобий, молибден, тантал, вольфрам и рений входят в этот список как основные, в то время как более широкое определение этих металлов позволяет включить в этот список ещё и элементы имеющие температуру плавления 2123 K (1850 °C) — титан, ванадий, хром, цирконий, гафний, рутений и осмий.
Трансурановые элементы (которые находятся за ураном, все изотопы которых нестабильны и на земле их найти очень трудно) никогда не будут относиться к тугоплавким металлам.
Сравнительная таблица степени тугоплавкости чистых металлов
Следует отметить, что тугоплавкие материалы не ограничиваются исключительно металлами. К этой категории относится ряд соединений – сплавы и легированные металлы, разработанных, чтобы улучшить определенные характеристики исходного материала.
Относительно чистых элементов, можно привести наглядную таблицу степени их температурной устойчивости. Возглавляет ее самый тугоплавкий металл, известный на сегодня, – вольфрам с температурой плавления 3422 0С. Такая осторожная формулировка связана с попытками выделить металлы, обладающие порогом расплава, превосходящим вольфрам.
Поэтому вопрос, какой металл самый тугоплавкий, может в будущем получить совсем иное определение.
https://youtube.com/watch?v=d9060b-BaPA
Пороговые величины остальных соединений приведены ниже:
- рений 3186;
- осмий 3027;
- тантал 3014;
- молибден 2623;
- ниобий 2477;
- иридий 2446;
- рутений 2334;
- гафний 2233;
- родий 1964;
- ванадий 1910;
- хром 1907;
- цирконий 1855;
- титан 1668.
Остается добавить еще один интересный факт, касающийся физических свойств жапропрочных элементов. Температура плавления некоторых из них чувствительная к чистоте материала. Ярким примером этому выступает хром, температура плавления которого может варьироваться от 1513 до 1920 0С, в зависимости от химического состава примесей. Поэтому, данные интернет пространства часто разнятся точными цифрами, однако качественная составляющая от этого не страдает.
Хром в чистом виде
Свойства самых тугоплавких металлов
Так самый тугоплавкий металл в мире (вольфрам) обычно легируется рением, торием, никелем при участии меди и/или железа. Первый делает сплав более коррозионстойким, второй — более надежным, а третий — придает небывалую плотность
Следует обратить внимание, что во всех сплавах вольфрама содержится не более 4/5
Из-за того, что вольфрам одновременно и твердый, и тугоплавкий его обычно применяют в электроснабжении, строении приборов, изготовлении оружия, снарядов, боеголовок и ракет. Более плотные сплавы (на базе никеля) применяют для производства клюшек для игры в гольф. Вольфрам образует и так называемые псевдосплавы. Дело в том, что в них металл не легируется, а наполняется жидким серебром или медью.
За счет разницы в температурах расплава получаются лучшие тепло и электропроводные свойства.
Это дает возможность использовать его для изготовления форм для литья цинковых деталей. Особое направления использования молибдена — в качестве легирующего элемента в стальных сплавах. Сплавы сталь+молибден обладают хорошей износостойкостью и невысокими показателями трения.
Сталь+молибден применяют в для изготовления труб, трубных конструкций, автомобиле и машиностроении.
Режущие свойства вольфрама
В 1864 году английский ученый Роберт Мюшет использовал вольфрам как легирующую добавку к стали, которая выдерживала красное каление и еще больше увеличивала твердость. Резцы, которые изготовляли из полученной стали, увеличили скорость резания металла в 1,5 раза, и она стала составлять 7,5 метра в минуту.
Работая в этом направлении, ученые получали все новые технологии, увеличивая скорость обработки металла с использованием вольфрама. В 1907 году появилось новое соединение вольфрама с кобальтом и хромом, которое стало основоположником твердых сплавов, способных увеличивать скорость резания. В настоящее время она возросла до 2000 метров в минуту, и все это благодаря вольфраму – самому тугоплавкому металлу.
История открытия
Рудокопы Саксонии в XIV-XVI вв. заметили, что после обработки оловянных руд остается много шлака. Работники в здешних копальнях называли его побочным продуктом, который «пожирает» олово, сравнивали с «волком, пожирающим овцу». Так и сформировалось название шлака «wolfrahm» («волчья пена» с немецкого языка).
Когда химик Карл Шееле обработал азотной кислотой «tungsten» («тяжелый камень» в переводе со шведского языка), удалось выделить новый метал, получивший такое же название. Событие произошло в 1781 г. Позже провели ряд анализов, которые показали, что шведскому химику удалось открыть не сам вольфрам, а его оксид. Поэтому минерал переименовали на «шеелит».
Через два года после открытия, сделанного Карлом Шееле, химики из Испании братья Элюар заявили, что смогли выделить из вольфрамита рудников Саксонии чистый вольфрам. Нужно отметить, что ни Шееле, ни братья Элюар не настаивали на том, что именно они стали первооткрывателями вольфрама.
До начала ХХ века химический элемент назывался «tungsten», его обозначали символом «Tu». Термин «вольфрам» и символ «W» был утвержден только в середине прошлого века.
Области применения
До середины 40-х годов тугоплавкие металлы использовались только как легирующие элементы для улучшения механических характеристик стальных цветных сплавов на основе меди и никеля в электропромышленности. Соединения молибдена и вольфрама применялись также в производстве твердых сплавов.
Техническая революция, связанная с активным развитием авиации, ядерной промышленности и ракетостроения, нашла новые способы использования тугоплавких металлов. Вот неполный перечень новых сфер применения:
- Производство тепловых экранов головного узла и каркасов ракет.
- Конструкционный материал для сверхзвуковых самолётов.
- Ниобий служит материалом сотовой панели космических кораблей. А в ракетостроении его используют в качестве теплообменников.
- Узлы термореактивного и ракетного двигателя: сопла, хвостовые юбки, лопатки турбин, заслонки форсунок.
- Ванадий является основой для изготовления тонкостенных трубок тепловыделяющих элементов термоядерного реактора в ядерной промышленности.
- Вольфрам применяется как нить накаливания электроламп.
- Молибден все шире и шире используется в производстве электродов, применяемых для плавки стекла. Помимо этого, молибден – металл, используемый для производства форм литья под давлением.
- Производство инструмента для горячей обработки деталей.
Рейтинг: /5 – голосов
Свойства
Чтобы понимать, где лучше использовать материал, нужно знать свойства тугоплавких металлов. Из них изготавливаются детали для промышленного оборудования, техники и электроники. Характеристики тяжелых тугоплавких металлов будут описаны ниже.
Физические свойства
Характеристики:
- Плотность — до 10000 кг/м3. У вольфрама этот показатель достигает 19000 кг/м3.
- Средняя температура плавления — 2500 градусов по Цельсию. Самая высокая температура плавления металла у вольфрама — 3390 градусов.
- Удельная теплоёмкость — 400 Дж.
Тугоплавкие предметы не выдерживают ударов и падений.
Химические свойства
Химические свойства:
- Это твердые вещества, обладающие высокой химической активностью.
- Прочная межатомная структура.
- Сопротивляемость длительному воздействию кислот и щелочей.
- Высокий показатель парамагнитности.
Эти материалы имеют некоторые недостатки. Главным из них является трудный процесс обработки и изготовления продукции из него.