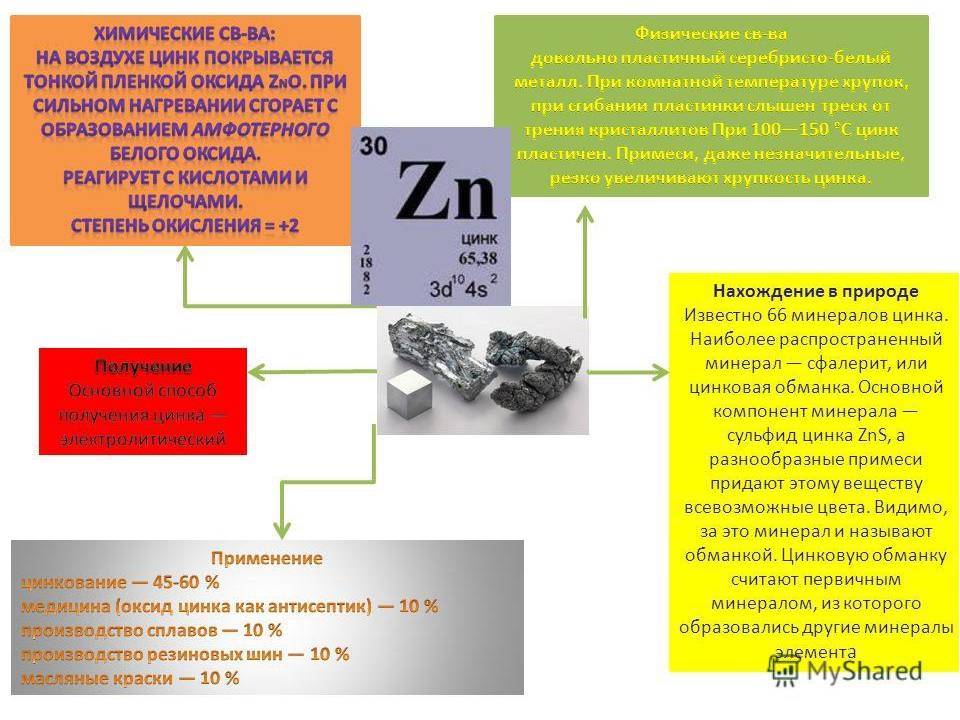
ПРИМЕНЕНИЕ
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота (и других металлов) из чернового свинца в виде интерметаллидов цинка с серебром и золотом (так называемой «серебристой пены»), обрабатываемых затем обычными методами аффинажа.
Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах.
Пластины цинка широко используются в полиграфии, в частности, для печати иллюстраций в многотиражных изданиях. Для этого с XIX века применяется цинкография — изготовление клише на цинковой пластине при помощи вытравливания кислотой рисунка в ней. Примеси, за исключением небольшого количества свинца, ухудшают процесс травления. Перед травлением цинковую пластину подвергают отжигу и прокатывают в нагретом состоянии.
Цинк вводится в состав многих твёрдых припоев для снижения их температуры плавления.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.
Цинк — важный компонент латуни. Сплавы цинка с алюминием и магнием (ЦАМ, ZAMAK) благодаря сравнительно высоким механическим и очень высоким литейным качествам очень широко используются в машиностроении для точного литья. В частности, в оружейном деле из сплава ZAMAK (-3, −5) иногда отливают затворы пистолетов, особенно рассчитанных на использование слабых или травматических патронов. Также из цинковых сплавов отливают всевозможную техническую фурнитуру, вроде автомобильных ручек, корпусы карбюраторов, масштабные модели и всевозможные миниатюры, а также любые другие изделия, требующие точного литья при приемлемой прочности.
Хлорид цинка — важный флюс для пайки металлов и компонент при производстве фибры.
Теллурид, селенид, фосфид, сульфид цинка — широко применяемые полупроводники. Сульфид цинка — составная часть многих люминофоров. Фосфид цинка используется в качестве отравы для грызунов.
Селенид цинка используется для изготовления оптических стёкол с очень низким коэффициентом поглощения в среднем инфракрасном диапазоне, например, в углекислотных лазерах.
Цинк (англ. Zinc) – Zn
| Молекулярный вес | 65.39 г/моль |
| Происхождение названия | Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium II |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Получение чистого цинка
Как упоминалось выше – в природе чистого вида нет. В основном добыча производится из руд, в которых он идет с различными элементами.
Для получения чистого материала задействован специальный флотационный процесс с избирательностью (селективностью). После проведения процесса руда распадается на элементы: цинк, свинец, медь и так далее.
Добытый таким методом чистый металл обжигается в специальной печи. Там при определенных температурах сульфидное состояние материала переходит в оксидное. При обжиге выделяется газ с содержанием серы, направляемый для получения серной кислоты.
Чистый цинк
Есть 2 способа получения металла:
- Пирометаллургический – идет процесс обжигания, после — полученная масса восстанавливается с помощью чёрного угля и кокса. Конечным процессом является отстаивание.
- Электролитический – добытая масса обрабатывается серной кислотой. Полученный раствор подвергают электролизу, при этом металл оседает, его плавят в печах.
Цинк (Zn, Zincum)
История цинка
Цинк в чистом виде впервые выделил Уильям Чемпион в 1738 году, хотя латунь (сплав меди с цинком) использовали в Древнем Египте и Древней Греции (calorizator). Иногда первооткрывателем цинка называют немца С. Маргграфа, который в 1746 году разработал аналогичный способ выработки цинка и описал его более подробно, чем Чемпион. Названием цинк обязан Парацельсу, в чьих трудах встречаются слова zincum и zinken, которыми назван металл, видимо, из-за схожести его кристаллитов с иглами (zinke – зубец).
Общая характеристика цинка
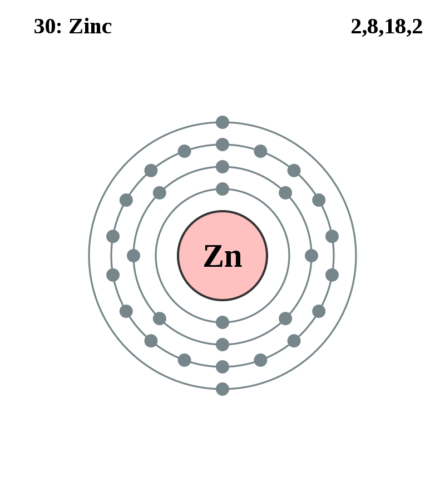
Цинк является элементом побочной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 30 и атомную массу 65,39. Принятое обозначение – Zn (от латинского Zincum).

Нахождение в природе
Цинк достаточно распространённый элемент, он содержится в земной коре, практически во всех водных ресурсах Мирового Океана и во многих живых организмах. На сегодняшний день известно более 60-ти минералов цинка (сфалерит, цинкит, каламин и др.). крупные месторождения цинка обнаружены в Австралии, Боливии, Иране и Казахстане.
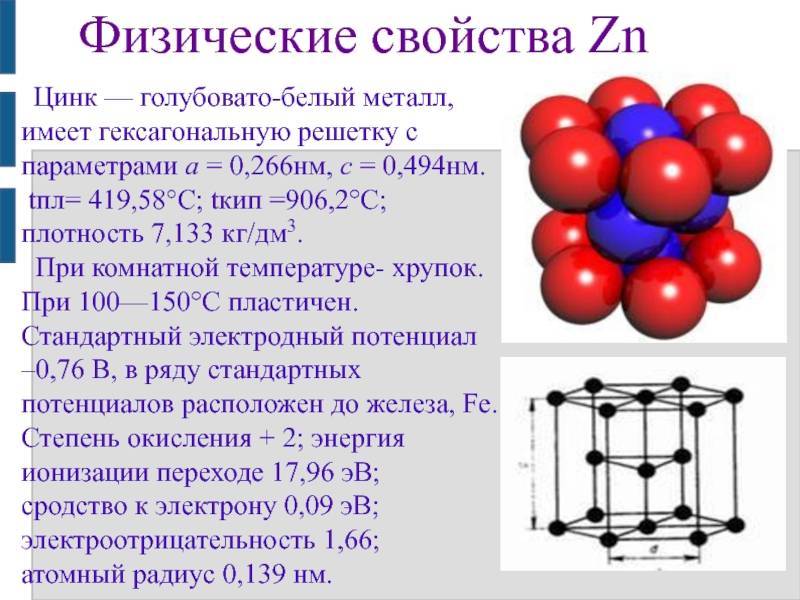
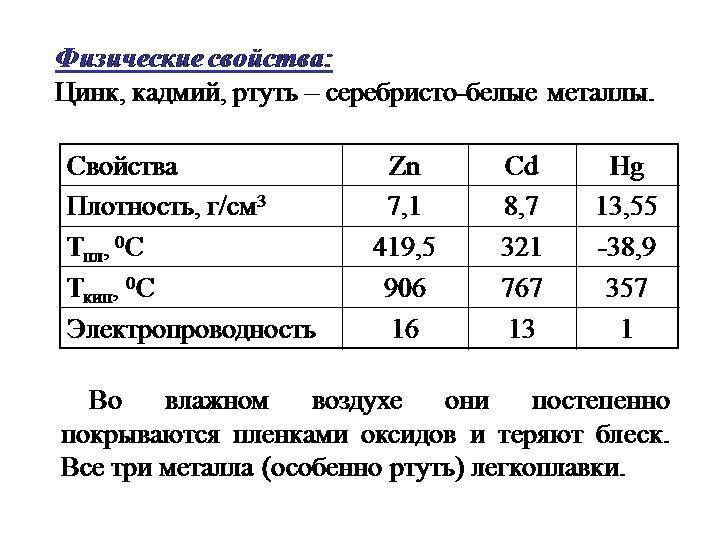
Физические и химические свойства
Цинк является хрупким, пластичным переходным металлом, имеет бело-голубоватый цвет, на воздухе покрывается слоем оксида цинка, что приводит к потускнению. При высоких температурах сгорает, образуя белый оксид цинка.
Суточная потребность в цинке
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, женщины в период беременности и кормления грудью – от 11 до 13 мг.
Продукты питания богатые цинком
Основные поставщики цинка – продукты питания, важный для жизнедеятельности организма элемент содержится в зелёных листовых овощах, брокколи, цветной капусте и редисе, моркови и кукурузе, зелёном луке, фасоли, горохе и чечевице, авокадо и ягодах, арахисе, кокосе, грецких и кедровых орехах, кунжуте, пшенице, овсянке и рисе. Присутствует цинк и в продуктах животного происхождения – свинине и баранине, говядине и индейке, мясе утки и говяжьем языке, морепродуктах и рыбе, плавленом сыре и яичном желтке.

Полезные свойства цинка и его влияние на организм
Функции и полезные свойства цинка:
- участие в формировании костных тканей,
- предупреждение диабета,
- препятствие появлению эпилепсии,
- обеспечение быстрого заживления ран,
- пособничество всасыванию витамина А,
- улучшение состояния волос,
- положительное влияние на умственные способности человека,
- профилактика возникновения артрита и ревматизма.
Взаимодействие с другими
Цинк необходим для метаболизма витамина E, витамин А действует только в присутствии цинка. Витамин С и цинк — хорошее средство против катаров и многих вирусных заболеваний.
Признаки нехватки цинка
Нехватка цинка в организме человека характеризуется следующими симптомами:
- расстройства деятельности желудочно-кишечного тракта,
- хрупкость ногтей и появление на них белых пятен,
- истощение и выпадение волос,
- потеря чувства вкуса и аппетита,
- незаживление мелких ран,
- нервозность, быстрая утомляемость,
- снижение памяти.

Признаки избытка цинка
Избыточное содержание цинка в организме человека как правило обусловлено приёмом БАДов и препаратов цинка, характеризуется головными болями, приступами слабости и тошнотой.
Применение цинка в жизни
Цинк в чистом виде используется как восстановитель благородных металлов, как защита стали от коррозии, для производства аккумуляторов, в полиграфической промышленности, в медицине, производстве различных сплавов, резиновых шин и масляных красок.

Природное образование и конечное формирование
Аналогично многим другим металлам, цинк в природе не встречается в чистом виде. Как правило, этот химический элемент присутствует в минералах, сочетаясь с другими элементами, и присутствует как:
- оксид,
- силикат,
- карбонат.
Можно сказать, это традиционная цинковая составляющая. Поэтому, чтобы воспроизвести чистый металл, придётся прибегнуть к переработке сырья цинксодержащего минерала, процедуре, которая предполагает многоступенчатый процесс очистки (включающий несколько отдельных физических и химических этапов).

Природный минерал, содержащий высокий процент химического вещества, широко используемого для самых разных целей. Структура минерала напоминает кварцевые образования характерными вкраплениями-блёстками Например, для переработки сульфида цинка необходимо измельчить сырьё в порошок, и тщательно промыть, чтобы избавиться от сульфидов других металлов, присутствующих в виде примесей. В конечном итоге получается оксид цинка (ZnO). Выщелачиванием (реакция с серной кислотой) получают раствор сульфата.
Затем используется электролиз (электрохимический процесс) для отделения чистого химического элемента. Также допустимо воспроизводить металл из минерального сырья путём плавки (нагревания углеродом), что традиционно и применяется в промышленном секторе.
История открытия Цинк Zincum
Открытие элемента Zincum — Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1738 году в Англии Уильямом Чемпионом был запатентован дистилляционный способ получения цинка.
В промышленном масштабе выплавка цинка началась также в XVIII в.: в 1743 году в Бристоле вступил в строй первый цинковый завод, основанный Уильямом Чемпионом, где получение цинка проводилось дистилляционным способом:
В 1746 А. С. Маргграф в Германии разработал похожий способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. Маргграф описал свой метод во всех деталях и этим заложил основы теории производства цинка. Поэтому его часто называют первооткрывателем цинка.
- 1805 году Чарльз Гобсон и Чарльз Сильвестр из Шеффилда запатентовали способ обработки цинка — прокатка при 100—150 °C
- 1 января 1905 — первый в России цинк был получен на
- 1915 году в Канаде и США — первые заводы, где цинк получали электролитическим способом
Цинк — общая характеристика элемента, химические свойства цинка и его соединений

Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d104s2.
В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка: 2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой: Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора: Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды: Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода: Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот: Zn + 2HCl → ZnCl2 + H2; Zn + H2SO4 → ZnSO4 + H2.
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония: 4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот: Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O; Zn + 4HNO3 → Zn(NO3)2 + 2NO2 + 2H2O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов: Zn + 2NaOH + 2H2O → Na2 + H2
при сплавлении образует цинкаты: Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка: 3Zn + 2NH3 → Zn3N2 + 3H2; растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка: Zn + 4NH3 + 2H2O → (OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов: Zn + CuSO4 → Cu + ZnSO4; Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO
– белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см3, температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом: ZnO + C → Zn + CO; ZnO + CO → Zn + CO2; ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей: ZnO + 2HCl → ZnCl2 + H2O; ZnO + 2NaOH + H2O → Na2.
При сплавлении с оксидами металлов образует цинкаты: ZnO + CoO → CoZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом: 2ZnO + SiO2 → Zn2SiO4, ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2
– бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см3, при температуре выше 125°С разлагается: Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах: Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O; Zn(OH)2 + 2NaOH → Na2;
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка: Zn(OH)2 + 4NH3 → (OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами: ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Цинка полезные свойства. Цинк (Zn, Zincum)
История цинка
Цинк в чистом виде впервые выделил Уильям Чемпион в 1738 году, хотя латунь (сплав меди с цинком) использовали в Древнем Египте и Древней Греции (calorizator). Иногда первооткрывателем цинка называют немца С. Маргграфа, который в 1746 году разработал аналогичный способ выработки цинка и описал его более подробно, чем Чемпион. Названием цинк обязан Парацельсу, в чьих трудах встречаются слова zincum и zinken , которыми назван металл, видимо, из-за схожести его кристаллитов с иглами ( zinke – зубец).
Общая характеристика цинка
Цинк является элементом побочной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 30 и атомную массу 65,39. Принятое обозначение – Zn (от латинского Zincum ).

Нахождение в природе
Цинк достаточно распространённый элемент, он содержится в земной коре, практически во всех водных ресурсах Мирового Океана и во многих живых организмах. На сегодняшний день известно более 60-ти минералов цинка (сфалерит, цинкит, каламин и др.). крупные месторождения цинка обнаружены в Австралии, Боливии, Иране и Казахстане.
Физические и химические свойства
Цинк является хрупким, пластичным переходным металлом, имеет бело-голубоватый цвет, на воздухе покрывается слоем оксида цинка, что приводит к потускнению. При высоких температурах сгорает, образуя белый оксид цинка.
Суточная потребность в цинке
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, женщины в период беременности и кормления грудью – от 11 до 13 мг.
Продукты питания богатые цинком
Основные поставщики цинка – продукты питания, важный для жизнедеятельности организма элемент содержится в зелёных листовых овощах, брокколи , цветной капусте и редисе , моркови и кукурузе , зелёном луке , фасоли , горохе и чечевице , авокадо и ягодах, арахисе , кокосе , грецких и кедровых орехах , кунжуте , пшенице , овсянке и рисе . Присутствует цинк и в продуктах животного происхождения – свинине и баранине , говядине и индейке , мясе утки и говяжьем языке , морепродуктах и рыбе, плавленом сыре и яичном желтке .

Полезные свойства цинка и его влияние на организм
Функции и полезные свойства цинка:
- участие в формировании костных тканей,
- предупреждение диабета,
- препятствие появлению эпилепсии,
- обеспечение быстрого заживления ран,
- пособничество всасыванию витамина А,
- улучшение состояния волос,
- положительное влияние на умственные способности человека,
- профилактика возникновения артрита и ревматизма.
Взаимодействие с другими
Цинк необходим для метаболизма витамина E , витамин А действует только в присутствии цинка. Витамин С и цинк — хорошее средство против катаров и многих вирусных заболеваний.
Признаки нехватки цинка
Нехватка цинка в организме человека характеризуется следующими симптомами:
- расстройства деятельности желудочно-кишечного тракта,
- хрупкость ногтей и появление на них белых пятен,
- истощение и выпадение волос,
- потеря чувства вкуса и аппетита,
- незаживление мелких ран,
- нервозность, быстрая утомляемость,
- снижение памяти.
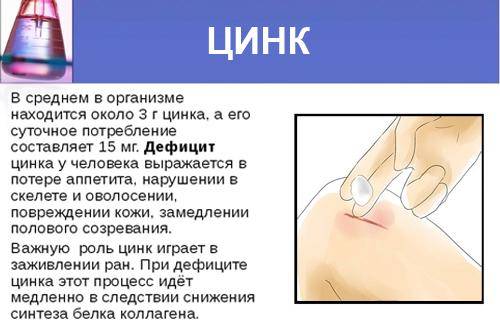
Признаки избытка цинка
Избыточное содержание цинка в организме человека как правило обусловлено приёмом БАДов и препаратов цинка, характеризуется головными болями, приступами слабости и тошнотой.
Применение цинка в жизни
Цинк в чистом виде используется как восстановитель благородных металлов, как защита стали от коррозии, для производства аккумуляторов, в полиграфической промышленности, в медицине, производстве различных сплавов, резиновых шин и масляных красок.

Копирование данной статьи целиком или частично запрещено.
Месторождения и получение
 Самородного цинка в природе не существует. Сегодня используется около 70 минералов, из которых его выплавляют. Самый известный — сфалерит (цинковая обманка), который содержится в незначительных количествах в организме человека и животных, а также в некоторых растениях. Больше всего — в фиалке.
Самородного цинка в природе не существует. Сегодня используется около 70 минералов, из которых его выплавляют. Самый известный — сфалерит (цинковая обманка), который содержится в незначительных количествах в организме человека и животных, а также в некоторых растениях. Больше всего — в фиалке.
Цинковые минералы добывают в Казахстане, Боливии, Австралии, Иране, России. Лидеры по производству — Китай, Австралия, Перу, США, Канада, Мексика, Ирландия, Индия.
На сегодняшний день самый популярный метод получения чистого металла — электролитический. Чистота получаемого металла почти стопроцентная (возможны лишь небольшие примеси в объёме не более нескольких сотых процента. В целом они незначительны, поэтому такой цинк считается чистым).
Общее производство цинка во всём мире оценивается примерно в более чем десять миллионов тонн в год.
Цинк Zincum происхождение названия
Откуда произошло название Zincum … Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или «zinken» в книге Liber Mineralium I. Слово, вероятно, восходит к нем. Zinke, означающее «зубец» (кристаллиты металлического цинка похожи на иглы)
Распространённость Цинк Zincum
Как любой хим. элемент имеет свою распространенность в природе, Zn …
Цинк в природе как самородный металл не встречается.
Получение Цинк Zincum
Zincum — получение элемента Цинк добывают из полиметаллических руд, содержащих 1—4 % Zn в виде сульфида, а также Cu, Pb, Ag, Au, Cd, Bi. Руды обогащают селективной флотацией, получая цинковые концентраты (50—60 % Zn) и одновременно свинцовые, медные, а иногда также пиритные концентраты. Цинковые концентраты обжигают в печах в кипящем слое, переводя сульфид цинка в оксид ZnO; образующийся при этом сернистый газ SO2 расходуется на производство серной кислоты. Чистый цинк из оксида ZnO получают двумя способами.
По пирометаллургическому (дистилляционному) способу, существующему издавна, обожжённый концентрат подвергают спеканию для придания зернистости и газопроницаемости, а затем восстанавливают углём или коксом при 1200—1300 °C: ZnO + С = Zn + CO. Образующиеся при этом пары металла конденсируют и разливают в изложницы. Сначала восстановление проводили только в ретортах из обожжённой глины, обслуживаемых вручную, позднее стали применять вертикальные механизированные реторты из карборунда, затем — шахтные и дуговые электропечи; из свинцово-цинковых концентратов цинк получают в шахтных печах с дутьём.
Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого металла от железа и части свинца при 500 °C), достигая чистоты 98,7 %. Применяющаяся иногда более сложная и дорогая очистка ректификацией дает металл чистотой 99,995 % и позволяет извлекать кадмий.
Основной способ получения цинка — электролитический (гидрометаллургический). Обожжённые концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка — 99,95 %, полнота извлечения его из концентрата (при учёте переработки отходов) — 93—94 %.
Кальцинирование
После того, как минерал был сконцентрирован после процесса флотации и очистки горных пород, его необходимо прокалить, чтобы превратить сульфиды в соответствующие им. На этом этапе минерал просто нагревается в присутствии кислорода, что приводит к следующей химической реакции:
2 ZnS + 3 O2(г) → 2 ZnO (т) + 2 SO2(грамм)
SO2 также реагирует с кислородом с образованием SO3, соединение, предназначенное для синтеза серной кислоты.
После получения ZnO его можно подвергнуть пирометаллургическому процессу или электролизу, конечным результатом которого является образование металлического цинка.
В продуктах питания
Элемент имеется в мясе, сыре, кунжуте, устрицах, шоколаде, бобовых, овсянке, подсолнечных и тыквенных семечках, часто присутствует в минеральной воде. Наибольший процент цинка содержится в следующих продуктах (из расчета на 100 грамм):
- Устрицы (до 40 мг), анчоусы (1,72 мг), осьминог (1,68 мг), карп (1,48 мг), икра (до 1 мг), сельдь (около 1 мг).
- Тыквенные семечки (10 мг), кунжут (7 мг), подсолнечные семечки (5,3 мг), арахис (4 мг), грецкие орехи (3 мг), миндаль (3 мг).
- Говядина (до 8,4 мг), баранина (до 6 мг), говяжья печень (4 мг), свинина (до 3,5 мг), курица (до 3,5 мг).
- Какао-порошок без сахара и подсластителей (6,81 мг), чистый горький шоколад (2,3 мг), шоколадные конфеты (до 2 мг в зависимости от количества и вида шоколада).
- Чечевица (4,78 мг), овес (3,97 мг), пшеница (3,46 мг), соевые бобы (3 мг), рожь (2,65 мг), хлеб (до 1,5 мг), зеленый горошек (1,24 мг), горох (1,2 мг), ростки бамбука (1,1 мг), рис (1 мг), злаковое печенье (до 1 мг).
- Твердый сыр (до 4 мг).
Свойства цинка (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Цинк |
| 102 | Прежнее название | |
| 103 | Латинское название | Zincum |
| 104 | Английское название | Zinc |
| 105 | Символ | Zn |
| 106 | Атомный номер (номер в таблице) | 30 |
| 107 | Тип | Металл |
| 108 | Группа | Амфотерный, переходный, цветной металл |
| 109 | Открыт | Известен с глубокой древности |
| 110 | Год открытия | до 1000 года до н. э. |
| 111 | Внешний вид и пр. | Хрупкий металл голубовато-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0078 % |
| 120 | Содержание в морях и океанах (по массе) | 5,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,00003 % |
| 122 | Содержание в Солнце (по массе) | 0,0002 % |
| 123 | Содержание в метеоритах (по массе) | 0,018 % |
| 124 | Содержание в организме человека (по массе) | 0,0033 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 65,38(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 |
| 203 | Электронная оболочка | K2 L8 M18 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 142 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 122 пм |
| 207 | Радиус иона (кристаллический) | Zn2+ 74 (4) пм, 88 (6) пм, 104 (8) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 139 пм |
| 209 | Электроны, Протоны, Нейтроны | 30 электронов, 30 протонов, 35 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 12-ая группа (по старой классификации – побочная подгруппа 2-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, 0, +1, +2 |
| 302 | Валентность | II |
| 303 | Электроотрицательность | 1,65 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 906,4 кДж/моль (9,394197(6) эВ) |
| 305 | Электродный потенциал | Zn2+ + 2e– → Zn, Eo = -0,763 В |
| 306 | Энергия сродства атома к электрону | 0 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 7,14 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 6,57 г/см3 (при температуре плавления 419,53 °C и иных стандартных условиях, состояние вещества – жидкость), 6,4 г/см3 (при 800 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 419,53 °C (692,68 K, 787,15 °F) |
| 403 | Температура кипения* | 907 °C (1180 K, 1665 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 7,32 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 115 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 25,47Дж/(K·моль) |
| 411 | Молярный объём | 9,2 см³/моль |
| 412 | Теплопроводность | 116 Вт/(м·К) (при стандартных условиях), 116 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
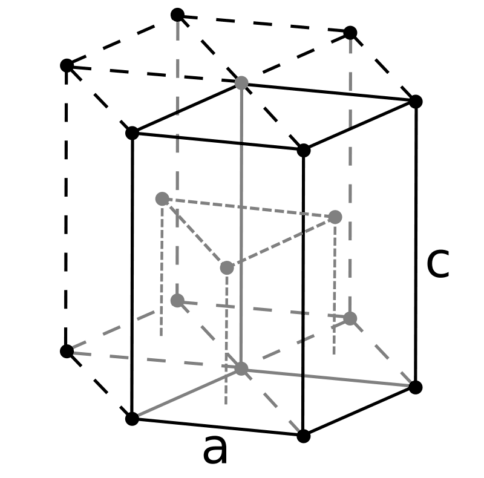
| 512 | Структура решётки | Гексагональная плотноупакованная
|
| 513 | Параметры решётки | a = 2,6648 Å, c = 4,9468 Å |
| 514 | Отношение c/a | 1,856 |
| 515 | Температура Дебая | 234 K |
| 516 | Название пространственной группы симметрии | P63/mmc |
| 517 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-66-6 |
Примечание:
205* Эмпирический радиус атома цинка согласно и составляет 134 пм и 138 пм соответственно.
206* Ковалентный радиус цинка согласно и составляет 122±4 пм и 125 пм соответственно.
401* Плотность цинка согласно и составляет 7,133 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), согласно составляет 6,59 г/см3 (при 500 °C и иных стандартных условиях, состояние вещества – жидкость).
402* Температура плавления цинка согласно и составляет 419,6 °С (692,75 K, 787,28 °F) и 419,5 °С (692,65 K, 787,1 °F).
403* Температура кипения цинка согласно и составляет 906,2 °С (1179,35 K, 1663,16 °F) и 906 °C (1179,15 К, 1662,8 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) цинка согласно и составляет 7,28 кДж/моль и 7,24 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) цинка согласно и составляет 114,8 кДж/моль и 115,3 кДж/моль соответственно.
410* Молярная теплоёмкость цинка согласно составляет 25,4 Дж/(K·моль).
Сырье для получения цинка
Основным источником получения цинка являются сульфидные, медно-свинцово-цинковые, медно-цинковые и свинцово-цинковые руды.
В сульфидных рудах цинк обычно присутствует в виде сфалерита или вуртцита, состав которых отвечает формуле ZnS, и марматита nZnS · mFeS. Спутниками цинка в полиметаллических рудах являются минералы и элементы.
В окисленных зонах месторождений цинксодержащих руд основными кислородсодержащими минералами цинка являются: смитсонит ZnCO3, цинкит ZnO и каламин ZnO·SiO2 ·H2O. Окисленные цинковые руды в настоящее время имеют подчиненное значение.
В сульфидных полиметаллических рудах содержание цинка обычно составляет 1…3 %. Эти руды имеют сложный состав. Все это обусловливает необходимость проведения предварительного обогащения руд по селективной схеме с получением нескольких концентратов.
Цинковые концентраты селективного флотационного обогащения полиметаллических руд содержат, %: Zn – 48…60; Pb – 1,5…2,5; Cu – 1…3; Cd – до 0,25; Fe – 3…10; S – 30…38, пустой породы – до 10.
Цинковые концентраты – комплексное дорогостоящее сырьё. Из них нужно извлекать цинк, свинец, медь, кадмий, серу, золото, серебро, ртуть, галлий, индий, таллий, селен, теллур и др.
Иногда при обогащении труднообогатимых медно-цинковых руд получают промежуточные продукты, содержащие 12…18 % Zn и 4…8 % Cu. Переработка этих материалов затруднена как на цинковых, так и на медных заводах.
Переработку цинковых концентратов в настоящее время осуществляют двумя методами – пирометаллургическим и гидрометаллургическим.
В основе пирометаллургического способа лежит процесс восстановления оксида цинка при 1000…1100 ºС, т. е. при температуре выше точки кипения металлического цинка, что обеспечивает выделение его в момент образования в парообразном состоянии и возгонку в виде паров:
ZnO + C = Znпар + CO; ZnO + CO = Znпар + CO2.
Пары цинка в дальнейшем конденсируют. Получение жидкого цинка дистилляцией возможно только в условиях сильно восстановительной атмосферы и полной герметизации применяемой аппаратуры.
В связи с тем что цинковый концентрат представляет собой сульфидный материал, а восстановление цинка возможно только из его оксида, дистилляции предшествует окислительный обжиг с полным удалением серы.
Возможны несколько вариантов аппаратурного оформления пирометаллургического способа получения цинка: в горизонтальных и вертикальных ретортах, в шахтных и электрических печах. Принцип действия положен в основу получения паров цинка в электротермической части кивцетного агрегата.
Получающийся пирометаллургическим способом цинк обязательно содержит большое количество металлов-примесей, возгоняемых вместе с ним или попадающих в него из выносимой газами пыли. Поэтому дистилляционный цинк, как и всякий черновой металл, нуждается в рафинировании.
Пирометаллургический способ применяют с момента возникновения цинкового производства. Доля выпуска цинка этим способом из года в год сокращается и в настоящее время составляет не более 20 %.
Гидрометаллургический способ является в настоящее время основным. Широкое распространение гидрометаллургии при производстве цинка обусловлено ее значительными преимуществами по сравнению с дистилляцией. К ним относятся:
- извлечение большего количества цинка и сопутствующих элементов;
- большая комплексность использования сырья;
- высокое качество цинка;
- высокая механизация трудоемких процессов.
По этому способу цинк выщелачивают раствором серной кислоты из предварительно обожженного концентрата. При выщелачивании цинк переходит в раствор в виде сернокислого цинка по реакции
ZnO + H2SO4 = ZnSO4 + H2O.
При выщелачивании цинкового огарка в раствор частично переходят содержащиеся в нем компоненты. Качество получаемого электролитическим осаждением цинка зависит от чистоты раствора: чем чище раствор, поступающий на электролиз, тем более чистым получается товарный цинк. Поэтому перед электролизом раствор тщательно очищают от примесей.
Процесс электролитического осаждения цинка из очищенного раствора протекает по следующей суммарной реакции:
ZnSO4 + H2O = Zn + H2SO4 + 0,5O2
Цинк при электролизе осаждается на катоде, а на аноде регенерируется серная кислота, необходимая для выщелачивания свежих порций огарка, и выделяется кислород. Катодные осадки цинка переплавляют и разливают в слитки.
Кек (нерастворенный осадок), получаемый после выщелачивания, подвергают дополнительной переработке с целью доизвлечения из него цинка и других ценных компонентов.