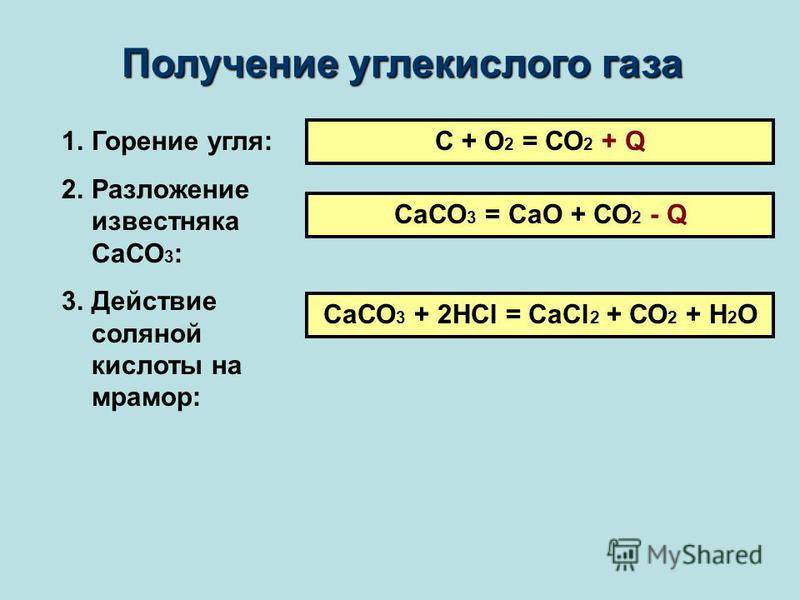
Применение
По ряду оценок, потребление СО2 на мировом рынке превышает 20 млн. метрических тонн в год. Столь высокий уровень потребления формируется под влиянием требований пищевой промышленности и нефтепромысловых предприятий, технологий газирования напитков и других промышленных нужд, например, снижения показателя Ph установок водоочистки, проблем металлургии (в том числе использования сварочного газа) и т.д.
Потребление углекислого газа неуклонно растет, поскольку расширяются сферы его применения, которые охватывают задачи от промышленного назначения до пищевого производства – консервация продуктов, в машиностроении от сварочного производства и приготовления защитных сварочных смесей до очистки поверхностей деталей гранулами «сухого льда», в сельском хозяйстве для подкормки растений, в газовой и нефтяной промышленности при пожаротушении.
Углекислый газ
Углекислый газ, двуокись или оксид углерода (IV) представляет собой газообразное бесцветное вещество, не имеющее запаха. Его химическая формула — CO2. Двуокись не горит и в минимальных концентрациях не представляет опасности для организма. Также она является необходимым элементом для нормальной жизнедеятельности растений.
Это соединение кислорода и углерода примерно в полтора раза тяжелее воздуха. Оно плохо растворяется в воде, а при повышении давления или охлаждении оксид становится твёрдым. Твёрдая углекислота известна под названием «сухой лёд». Она отличается способностью переходить из твёрдого состояния в газообразное, минуя жидкое.
Атом углерода в этом соединении имеет пару двойных связей с кислородными атомами. Полярность четырёх связей делает молекулу двуокиси неполярной. Это хорошо видно в структурной формуле оксида, которая наглядно демонстрирует связь атомов внутри молекулы:
О=С=О.
Взаимодействие с другими веществами
В химии углекислота считается солеобразующим оксидом, проявляющим слабые свойства окислителя. Она прекрасно взаимодействует с водой, причём эта реакция является практически полностью обратимой.
Вещество имеет следующие химические свойства:
- Вступление в реакцию с основными оксидами и основаниями. Соединение взаимодействует лишь с щелочами и их оксидами. При этом могут образовываться кислые и средние соли. К примеру, гидроксид калия в таком случае образует гидрокарбонат калия, который является кислой солью. Если же щелочи много, то получится карбонат калия — средняя соль.
- Взаимодействие с карбонатами с последующим образованием гидрокарбонатов.
- Реакции с некоторыми восстановителями, например, с углеродом, магнием и пероксидом натрия.
Методы получения
Углекислый газ получают и в лабораториях, и в промышленности. В лабораторных условиях для его производства применяются следующие методы:
- Воздействие сильными кислотными веществами на карбонаты и гидрокарбонаты различных металлов.
- Углекислое соединение образуется, когда растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III).
- Разложение растворимых гидрокарбонатов и нерастворимых карбонатов при высоких температурах.
На производстве двуокись получают из печных газов, а также из продуктов разложения известняка и доломита. Для этого смесь веществ промывают раствором карбоната калия. Реагент поглощает углекислоту и становится гидрокарбонатом. Получившееся вещество нагревают, что приводит к его разложению и высвобождению оксида углерода. Затем газ закачивают в баллоны.
Применение углекислоты
Химические и физические характеристики соединения позволяют использовать его в самых разных областях. Так, вещество активно применяется в химической промышленности, металлургии и при производстве бумаги.
А также углекислота применяется в следующих сферах деятельности:
- сварка;
- сельское хозяйство;
- медицина;
- фармацевтика;
- приборы и оборудование;
- защита окружающей среды;
- пищевая промышленность;
- пневматическое оружие.
Очень востребован этот вид оксида углерода в системах пожаротушения. Им наполняют специальные огнетушители. Их принцип действия основан на том, что углекислота не горит и весит больше воздуха. За счёт этого вещество окутывает очаг возгорания и перекрывает для огня источник кислорода, которые необходим для поддержания процесса горения. В таких условия пламя довольно быстро гаснет.
Физиологическое действие
Углекислота — нетоксичное вещество. Но если в воздухе её становится слишком много, то все живые организмы, дышащие кислородом, могут испытывать приступы удушья, способные привести к смерти. По этой причине углекислому газу присвоен четвёртый класс опасности.
Если уровень находящегося в воздухе углеродного соединения составляет от 2 до 4%, то человек чувствует сонливость и слабость. Когда концентрация двуокиси достигает 7—10%, начинают появляться симптомы удушья, похожи на признаки высотной болезни:
- головная боль;
- головокружение;
- слуховые расстройства;
- потеря сознания.
Чем выше концентрация газа в атмосфере, тем длительнее проявляются симптомы. При очень высокой концентрации оксида человек или животное быстро погибает от удушья, которое вызывается гипоксией.
Само по себе вдыхание воздуха с высоким содержанием двуокиси неопасно, а потому не влечёт за собой длительных проблем со здоровьем. После того как пострадавший переносится в атмосферу с обычным уровнем углекислоты, его самочувствие приходит в норму.
Зачем нужна инсуффляция при эндоскопии?
В норме все отделы толстого кишечника человека имеют небольшой диаметр (в среднем 4-6 см). Кроме того, слизистая оболочка желудочно-кишечного тракта имеет множество складок, ямочек и своеобразных углублений в виде карманов. Они нужны для увеличения «рабочей» поверхности и нормального процесса пищеварения – продвижения и расщепления пищевых масс, всасывания питательных веществ.
Инсуффляция предполагает нагнетание в просвет пищевода и желудка или толстой кишки углекислого газа, для этого к эндоскопическому оборудованию подключается специальный аппарат – инсуффлятор. Современные модели позволяют не только регулировать уровень подачи газа, но и контролируют входное и выходное давление, а также способны подогревать углекислый газ.
Основная цель проведения инсуффляции – облегчение прохождения эндоскопа. Постепенное нагнетание газа позволяет расширить просвет пищевода или кишечника, что дает возможность беспрепятственно провести инструмент в желудок или по отделам толстой кишки.
Сначала инсуффляцию проводили воздухом, при этом специалисты отмечали, что болезненные ощущения при проведении обследования были выраженными. Более того, после манипуляции пациенты продолжительное время отмечали значительный дискомфорт: вздутие, боли в животе, ощущение распирания. После внедрения в практику инсуффляции углекислым газом общая удовлетворенность процедурой возросла в несколько раз – это связано с тем, что в отличие от воздуха углекислый газ всасывается быстрее в несколько десятков раз. Следовательно, неприятные симптомы выражены менее ярко и беспокоят пациентов значительно реже.
Среди преимуществ инсуффляции углекислым газом можно отметить:
- сокращение сроков проведения исследования – за счет облегчения работы для врача-эндоскописта продолжительность процедуры значительно сокращается;
- хорошая визуализация и высокая информативность – поле зрения специалиста расширяется, следовательно, вероятность диагностических ошибок минимальна;
- уменьшение неприятных ощущений во время процедуры, особенно боли в животе;
- отсутствие болезненности или дискомфорта после манипуляции;
- уменьшение интенсивности послеоперационных симптомов (например, боль после удаления полипов толстой кишки).
Именно поэтому современный вариант колоноскопии и других эндоскопических исследований подразумевает проведение инсуффляции углекислым газом.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Ваша оценка?
Мне нравитсяНе нравится
Плотность углекислого газа (CO2), значение и примеры
Плотность углекислого газа и другие его физические свойства
Он плохо растворяется в воде, частично реагируя с ней.
Основные константы углекислого газа приведены в таблице ниже.
Таблица 1. Физические свойства и плотность углекислого газа.
Плотность, кг/м3 | 1,9768 |
Удельная теплота плавления, кДж/моль | 25,13 |
Динамическая вязкость, Па×с | 8,5×10-5 |
Молярная масса, г/моль | 44,01 |
Углекислый газ играет важную роль в биологических (фотосинтез), природных (парниковый эффект) и геохимических (растворение в океанах и образование карбонатов) процессах. В больших количествах он поступает в окружающую среду в результате сжигания органического топлива, гниения отходов и др.
Химический состав и строение молекулы углекислого газа
Химический состав молекулы углекислого газа выражается эмпирической формулой CO2. Молекула диоксида углерода (рис. 1) линейная, что соответствует минимальному отталкиванию связывающих электронных пар, длина связи С=Щ равна 0,116 нм, а её средняя энергия – 806 кДж/моль. В рамках метода валентных связей две σ-связи С-О образованы sp-гибридизованнойорбиталью атома углерода и 2pz – орбиталями атомов кислорода. Не участвующие в sp-гибридизации 2px— и 2py-орбитали атома углерода перекрываются с аналогичными орбиталями атомов кислорода. При этом образуются две π-орбитали, расположенные во взаимно перпендикулярных плоскостях.
Рис. 1. Строение молекулы углекислого газа.
Благодаря симметричному расположению атомов кислорода молекула CO2 неполярная, поэтому диоксид мало растворим в воде (один объем CO2 в одном объеме H2O при 1 атм и 15oС). Неполярность молекулы приводит к слабым межмолекулярным взаимодействия и низкой температуре тройной точки: t = -57,2oС и P = 5,2 атм.
Краткое описание химических свойств и плотность углекислого газа
Химически углекислый газ инертен, что обусловлено высокой энергией связей O=C=O. С сильными восстановителями при высоких температурах диоксид углерода проявляет окислительные свойства. Углем он восстанавливается до угарного газа CO:
C + CO2 = 2CO (t = 1000oC).
Магний, зажженный на воздухе, продолжает гореть и в атмосфре углекислого газа:
CO2 + 2Mg = 2MgO + C.
Оксид углерода (IV) частично реагирует с водой:
CO2(l) + H2O = CO2×H2O(l) H2CO3(l).
Проявляет кислотные свойства:
CO2 + NaOHdilute = NaHCO2;
CO2 + 2NaOHconc = Na2CO3 + H2O;
CO2 + Ba(OH)2 = BaCO3↓ + H2O;
CO2 + BaCO3(s) + H2O = Ba(HCO3)2(l).
При нагревании до температуры свыше 2000oС углекислый раз разлагается:
2CO2 = 2CO + O2.
Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:
Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Желудочно-кишечный тракт
Углекислый газ в организм попадает не только при дыхании, но и вместе с пищей. Углерод содержится практически во всех органических веществах, наибольшая концентрация содержится в продуктах растительного происхождения. Больше всего его образуется при расщеплении легкоусвояемых углеводов.

Углекислота влияет на химический состав жидкости в теле человека, хотя и не так значительно, но при сильном понижении или превышении может оказывать губительное воздействие. В организме почти все процессы жизнедеятельности клеток происходят при определенном уровне кислотно-щелочного баланса, который скорее близок к нейтральной воде, чем к кислоте. Наличие повышенной концентрации CO2 в употребляемых продуктах сильно меняет состав жидкости в теле человека. Это также влияет на протекание биохимических процессов. Происходит нарушение обмена веществ, гибель клеток или неправильный процесс их деления, что очень опасно.
 Продукты и их кислотно-щелочной баланс
Продукты и их кислотно-щелочной баланс
Поэтому продукты, содержащие CO2 в свободном состоянии (газировка) во многих странах запрещены к продаже.
Наибольший вред они наносят организму:
- При любых заболеваниях желудочно-кишечного тракта, в том числе хронических. Так как при приеме в пищу таких продуктов, происходит раздражение слизистой желудка. Они стимулируют выработку ферментов и повышают кислотность желудочного сока, что приводит к обострению имеющихся воспалительных процессов, образованию или углублению язвочек.
- Детям, до трех лет не стоит давать такие продукты, потому что их организм еще не совсем сформировался. Поэтому углекислота может привести к нарушению обмена веществ в организме и в будущем стать причиной высокой хрупкости костей.
- Диоксид углерода может вызвать аллергическую реакцию у человека.
- При наличии лишнего веса нельзя употреблять такие продукты, так как полнота, это следствие нарушения обмена веществ. А употребление продуктов с высоким содержанием CO2 приведет только к усугублению ситуации.
Во многих западных странах принят закон, в соответствии с которым наличие углекислого газа в продуктах не должно превышать 0,4%. Исключение дается только простой минеральной воде с газом, но только в том случае, если она содержит незначительное количество диоксида углерода. Но и это допустимо только по разрешению или рекомендации врача, особенно при болезнях желудка.
Искусственные источники углекислого газа
Углекислый газ попадает в атмосферу и в результате человеческой жизнедеятельности. Самыми активными источниками в наше время считаются:
- Индустриальные выбросы, происходящие в ходе сгорания топлива на электростанциях и в технологических установках
- Выхлопные газы двигателей внутреннего сгорания транспортных средств: автомобилей, поездов, самолетов и судов.
- Сельскохозяйственные отходы — гниение навоза в больших животноводческих комплексах
Кроме прямых выбросов, существует и косвенное воздействие человека на содержание CO2 в атмосфере. Это массовая вырубка лесов в тропической и субтропической зоне, прежде всего в бассейне Амазонки.
Искусственный источник углекислого газа
Несмотря на то, что в атмосфере Земли содержится менее процента диоксида углерода, он оказывает все возрастающее действие на климат и природные явления. Углекислый газ участвует в создании так называемого парникового эффекта путем поглощения теплового излучения планеты и удерживания этого тепла в атмосфере. Это ведет к постепенному, но весьма угрожающему повышению среднегодовой температуры планеты, таянию горных ледников и полярных ледяных шапок, росту уровня мирового океана, затоплению прибрежных регионов и ухудшению климата в далеких от моря странах.
https://youtube.com/watch?v=8IkNnmhQo-A
Знаменательно, что на фоне общего потепления на планете происходит значительное перераспределение воздушных масс и морских течений, и в отдельных регионах среднегодовая температура не повышается, а понижается. Это дает козыри в руки критикам теории глобального потепления, обвиняющим ее сторонников в подтасовке фактов и манипуляции общественным мнением в угоду определенным политическим центрам влияния и финансово-экономическим интересам
Человечество пытается взять под контроль содержание углекислого газа в воздухе, были подписаны Киотский и Парижский протоколы, накладывающие на национальные экономики определенные обязательства. Кроме того, многие ведущие автопроизводители автомобилей объявили о сворачивании к 2020-25 годам выпуска моделей с двигателями внутреннего сгорания и переходе на гибриды и электромобили. Однако некоторые ведущие экономики мира, такие, как Китай и США, не торопятся выполнять старые и брать на себя новые обязательства, мотивируя это угрозой уровню жизни в своих странах.
Углекислый газ и мы: чем опасен CO2
Углекислый газ — один из продуктов обмена веществ в организме человека. Он играет большую роль в управлении дыханием и снабжением кровью органов. Рост содержания CO2 в крови вызывает расширение сосудов, способных таким образом транспортировать больше кислорода к тканям и органам. Аналогично и система дыхания понуждается к большей активности, если концентрация углекислоты в организме растет. Это свойство используют в аппаратах искусственной вентиляции легких, чтобы подстегнуть собственные органы дыхания пациента к большей активности.
https://youtube.com/watch?v=DqbvEhn5uJc
Кроме упомянутой пользы, превышение концентрации СO2 может принести организму и вред. Повышенное содержание во вдыхаемом воздухе приводит к тошноте, головной боли, удушью и даже к потере сознания. Организм протестует против углекислого газа и подает человеку сигналы. При дальнейшем увеличении концентрации развивается кислородное голодание, или гипоксия. Co2 мешает кислороду присоединяться к молекулам гемоглобина, которые и осуществляют перемещение связанных газов по кровеносной системе. Кислородное голодание ведет к снижению работоспособности, ослаблению реакции и способностей к анализу ситуации и принятию решений, апатии и может привести к смерти.
Общие симптомы отравления углекислым газом
Такие концентрации углекислого газа, к сожалению, достижимы не только в тесных шахтах, но и в плохо проветриваемых школьных классах, концертных залах, офисных помещениях и транспортных средствах — везде, где в замкнутом пространстве без достаточного воздухообмена с окружающей средой скапливается большое количество людей.
Углекислый газ в природе естественные источники
К таким источникам относятся окислительные процессы разной интенсивности:
- Дыхание живых организмов. Из школьного курса химии и ботаники все помнят, что в ходе фотосинтеза растения поглощают углекислый газ и выделяют кислород. Но не все помнят, что это происходит только днем, при достаточном уровне освещения. В темное время суток растения наоборот, поглощают кислород и выделяют углекислый газ. Так что попытка улучшить качество воздуха в комнате, превращая ее в заросли фикусов и герани может сыграть злую шутку.
- Извержения и другая вулканическая активность. CO2 выбрасывается из глубин мантии Земли вместе с вулканическими газами. В долинах рядом с источниками извержений газа настолько много, что, скапливаясь в низинах, он вызывает удушье животных и даже людей. Известны несколько случаев в Африке, когда задыхались целые деревни.
- Горение и гниение органики. Горение и гниение — это одна и та же реакция окисления, но протекающая с разной скоростью. Богатые углеродом разлагающиеся органические остатки растений и животных, лесные пожары и тлеющие торфяники — все это источники диоксида углерода.
- Самым же большим природным хранилищем CO2 являются воды мирового океана, в которых он растворен.
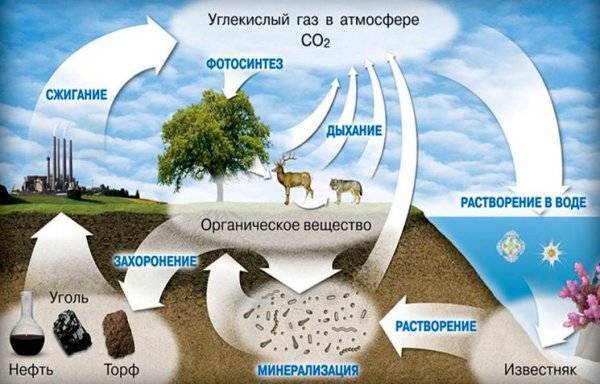
Углекислый газ в природе
За миллионы лет эволюции основанной на углеродных соединениях жизни на Земле в различных источниках накопились многие миллиарды тонн углекислого газа. Его одномоментный выброс в атмосферу приведет к гибели всего живого на планете из-за невозможности дыхания. Хорошо, что вероятность такого одномоментного выброса стремится к нулю.
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.
Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).
Установка добычи углекислоты
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.
Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.
Сухой лед
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Влияние на атмосферу
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего предполагается, что он должен участвовать в процессе глобального потепления.
Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Рост содержания углекислого газа до определённой концентрации приводит к появлению облаков из углекислоты, что ведет к похолоданию. Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.
Дискуссия недели
Джонатан Кузель — основатель некоммерческой эко-организации Sierra Institute for Community and Environment. Он живет в штате Калифорния и много раз сталкивался с последствиями лесных пожаров — дважды они напрямую угрожали его жизни. Кузель уверен, что распространению огня способствуют старые и больные деревья, который легко воспламеняются. Во время пожара в воздух выбрасывается столько же углекислого газа, сколько в год производят 750 тыс. автомобилей. Кузель считает, что древесину необходимо перерабатывать и использовать в качестве топлива. Тогда пожаров и выбросов станет меньше.
С ним согласны не все. Многие ученые указывают на то, что производители биотоплива часто увлекаются и используют не только старые деревья, но и молодые и здоровые. По данным природоохранной организации Dogwood Alliance, с 2002 года на юге США вырубили 40 млн акров смешанного леса (примерно 160 тыс. км²) и засадили эту территорию соснами. Из-за этого многие виды животных и насекомых вымерли. К тому же фабрики, которые сжигают биомассу, производят в 1,5 раза больше углекислого газа, чем угольные заводы.
Что посмотреть: Документальный фильм «2040: Будущее ждет», в котором австралийский актер и режиссер Дэймон Гамо рассказывает своей четырехлетней дочери о том, как сохранить мир при помощи эко-технологий.
Откуда же появляется углекислый газ?
Почва
Данный вид газа активно образуется в результате химических процессов в толще Земли. Он способен выходить через трещины и разломы в земной коре, что представляет большую опасность для работников шахт горнодобывающей промышленности. Как правило, в шахтном воздухе углекислый газ присутствует практически всегда в повышенном количестве.
В некоторых видах горных выработок, например, на угольных и калийных месторождениях, газ способен накапливаться с большой скоростью. Повышенная концентрация приводит к ухудшению самочувствия и удушению, поэтому максимальное значение не должно превышать 1% от общего объема воздуха в шахте.
Промышленность и транспорт
Одним из крупнейших источников образования углекислого газа являются различные заводы. Промышленные предприятия в ходе выполнения технологических процессов вырабатывают его в огромном количестве, выбрасывая в атмосферу. Такое же влияние оказывает транспорт. В богатом составе выхлопных газов имеется также и углекислый газ. При этом большую долю его выбросов в атмосферу планеты вносят самолеты. На втором месте идет наземный транспорт. Наибольшая концентрация создается над крупным городами, которым присущи не только большое количество автомобилей, но и затяжные «пробки».
Дыхание
Практически все живые существа планеты, при выдыхании выделяют углекислый газ. Он образуется в результате химических обменных процессов в легких и тканях. Это количество в масштабах планеты, даже с учетом миллиардов существ, весьма незначительно. Однако есть обстоятельства, когда о выделении углекислого газа с дыханием необходимо помнить.
В первую очередь, это замкнутые пространства, комнаты, аудитории, лифты и т.д. При скоплении достаточного количества людей на ограниченной территории достаточно быстро наступает духота. Она является недостатком кислорода из-за того, что он замещается выдыхаемым углекислым газом, который непригоден для дыхания. Чтобы избежать этого, необходимо осуществлять естественную или принудительную вентиляцию, с целью введения в помещение нового воздуха с улицы. Вентилирование помещений может производиться как при помощи обычных форточек, так и сложных систем с системой воздуховодов и нагнетающими турбинами.