Производство
 Производители ниобия в 2006-2015 гг.
Производители ниобия в 2006-2015 гг.
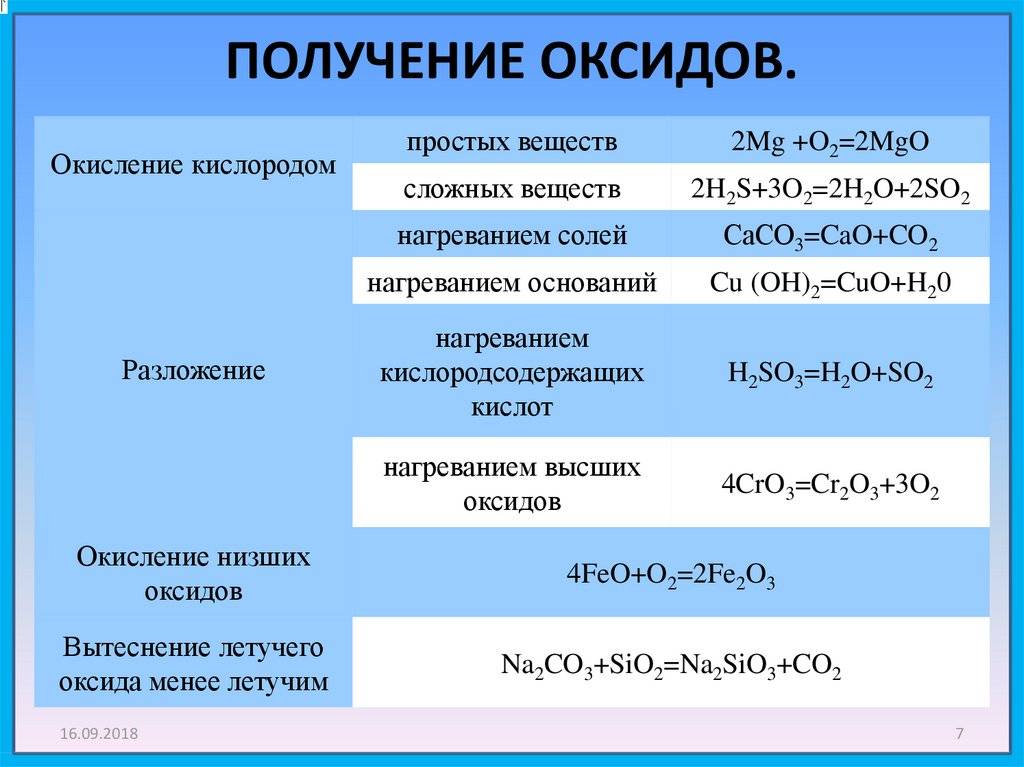
После отделения от других минералов получают смешанные оксиды тантала Ta 2 O 5 и ниобия Nb 2 O 5 . Первым этапом обработки является реакция оксидов с плавиковой кислотой :
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5 ] + 3 H 2 O
Первое разделение в промышленном масштабе, разработанное де Мариньяком , использует различные растворимости комплексных фторидов ниобия и тантала , моногидрата оксипентафторониобата калия (K 2 [NbOF 5 ] · H 2 O) и гептафтортанталата калия (K 2 [TaF 7 ]) в вода. В более новых процессах используется жидкостная экстракция фторидов из водного раствора органическими растворителями, такими как циклогексанон . Комплексные фториды ниобия и тантала экстрагируют отдельно из органического растворителя водой и либо осаждают добавлением фторида калия с получением комплекса фторида калия, либо осаждают аммиаком в качестве пентоксида:
- H 2 [NbOF 5 ] + 2 KF → K 2 [NbOF 5 ] ↓ + 2 HF
С последующим:
- 2 H 2 [NbOF 5 ] + 10 NH 4 OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Для восстановления до металлического ниобия используется несколько методов . Электролизе расплавленной смеси K 2 [NbOF 5 ] и хлорида натрия является одним; другой – восстановление фторида натрием . С помощью этого метода можно получить ниобий относительно высокой чистоты. При крупномасштабном производстве Nb 2 O 5 восстанавливают водородом или углеродом. В алюмотермической реакции смесь оксида железа и оксида ниобия реагирует с алюминием :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Для усиления реакции добавляют небольшие количества окислителей, таких как нитрат натрия . В результате получается оксид алюминия и феррониобий , сплав железа и ниобия, используемый в производстве стали. Феррониобий содержит от 60 до 70% ниобия. Без оксида железа для производства ниобия используется алюминотермический процесс. Для получения класса сверхпроводящих сплавов необходима дополнительная очистка . Электронно-лучевая плавка в вакууме – метод, используемый двумя основными распространителями ниобия.
По состоянию на 2013 год CBMM из Бразилии контролировал 85 процентов мирового производства ниобия. По оценкам Геологической службы США, производство увеличилось с 38 700 тонн в 2005 году до 44 500 тонн в 2006 году. Мировые ресурсы оцениваются в 4 400 000 тонн. За десятилетний период с 1995 по 2005 год производство увеличилось более чем вдвое, начиная с 17 800 тонн в 1995 году. В период с 2009 по 2011 год производство было стабильным на уровне 63 000 тонн в год с небольшим снижением в 2012 году до 50 000 тонн в год. .
| Страна | 2000 г. | 2001 г. | 2002 г. | 2003 г. | 2004 г. | 2005 г. | 2006 г. | 2007 г. | 2008 г. | 2009 г. | 2010 г. | 2011 г. | 2012 г. | 2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Австралия | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | ? | ? |
| Бразилия | 30 000 | 22 000 | 26 000 | 29 000 | 29 900 | 35 000 | 40 000 | 57 300 | 58 000 | 58 000 | 58 000 | 58 000 | 45 000 | 53 100 |
| Канада | 2290 | 3 200 | 3 410 | 3 280 | 3 400 | 3 310 | 4 167 | 3020 | 4380 | 4330 | 4 420 | 4 630 | 4,710 | 5 260 |
| Конго ДР | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | ? | ? |
| Мозамбик | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | ? | ? |
| Нигерия | 35 год | 30 | 30 | 190 | 170 | 40 | 35 год | ? | ? | ? | ? | ? | ? | ? |
| Руанда | 28 год | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | ? | ? |
| Мир | 32 600 | 25 600 | 29 900 | 32 800 | 34 000 | 38 700 | 44 500 | 60 400 | 62 900 | 62 900 | 62 900 | 63 000 | 50 100 | 59 400 |
Меньшие количества находятся на месторождении Каньяка в Малави ( рудник Каньяка ).
Примечания[ | ]
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 249. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8.
- Materials Handbook: A Concise Desktop Reference, François Cardarelli, 2000, с.157.
- Венецкий С.И. Сорок первый // Рассказы о металлах. — Москва: Металлургия, 1979. — 240 с. — 60 000 экз.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- Редкий ниобий на редкоземельном рынке
- Месторождение ниобия и тантала
- Larry D. Cunningham. USGS Minerals Information: Niobium (Columbium) and Tantalum(неопр.) . Minerals.usgs.gov (5 апреля 2012). Дата обращения: 17 августа 2012. Архивировано 25 ноября 2012 года.
- Запуск коллайдера//«Наука и технологии России» (неопр.) (недоступная ссылка). Дата обращения: 7 февраля 2009. Архивировано 21 сентября 2008 года.
- Ниобиевые монеты: очарование цвета (неопр.) (недоступная ссылка). Euro-Coins.News. Дата обращения: 12 марта 2012. Архивировано 28 мая 2012 года.
- Каталог коллекционных монет Австрии из драгоценных металлов (неопр.) (недоступная ссылка). Мир монет. Дата обращения: 19 марта 2012. Архивировано 15 февраля 2012 года.
- Для этого используется также титан в тех же количествах.
- Coin of time (неопр.) (недоступная ссылка). Дата обращения: 5 декабря 2007. Архивировано 12 марта 2008 года.
- Coin of time2 (неопр.) (недоступная ссылка). Дата обращения: 5 декабря 2007. Архивировано 22 мая 2009 года.
Производство [ править ]
Гидролиз править
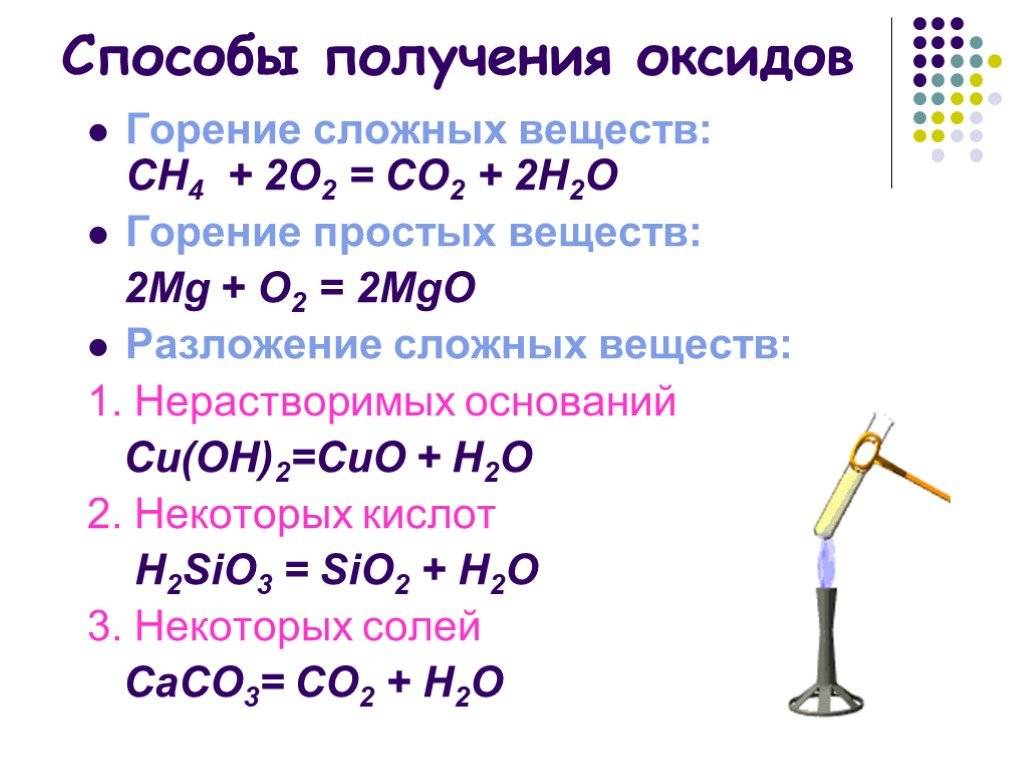
Nb 2 O 5 получают гидролизом ниобатов, алкоксидов или фторидов щелочных металлов с использованием основания. Такие якобы простые процедуры дают гидратированные оксиды, которые затем можно прокалить . Чистый Nb 2 O 5 также можно получить гидролизом NbCl 5 :
- 2 NbCl 5 + 5 H 2 O → Nb 2 O 5 + 10 HCl
Сообщалось о способе получения с помощью золь-гель методов гидролиза алкоксидов ниобия в присутствии уксусной кислоты с последующим прокаливанием гелей с получением орторомбической формы T-Nb 2 O 5 .
Окисление править
Учитывая, что Nb 2 O 5 является наиболее распространенным и надежным соединением ниобия, существует множество методов, как практических, так и эзотерических, для его образования. Оксид, например, возникает, когда металлический ниобий окисляется на воздухе. Окисление диоксида ниобия NbO 2 на воздухе приводит к образованию полиморфа L-Nb 2 O 5 .
Наноразмерные частицы пентоксида ниобия были синтезированы восстановлением LiH NbCl 5 с последующим окислением в воздухе как часть синтеза наноструктурированных ниобатов. [ необходима цитата ]
Производство
Производители ниобия в 2006-2015 гг.
После отделения от других минералов получают смешанные оксиды тантала Ta 2 O 5 и ниобия Nb 2 O 5 . Первым этапом обработки является реакция оксидов с плавиковой кислотой :
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5 ] + 3 H 2 O
Первое разделение в промышленном масштабе, разработанное де Мариньяком , использует различные растворимости комплексных фторидов ниобия и тантала , моногидрата оксипентафторониобата калия (K 2 [NbOF 5 ] · H 2 O) и гептафтортанталата калия (K 2 [TaF 7 ]) в воды. В более новых процессах используется жидкостная экстракция фторидов из водного раствора органическими растворителями, такими как циклогексанон . Комплексные фториды ниобия и тантала экстрагируют отдельно из органического растворителя водой и либо осаждают добавлением фторида калия с получением комплекса фторида калия, либо осаждают аммиаком в качестве пентоксида:
- H 2 [NbOF 5 ] + 2 KF → K 2 [NbOF 5 ] ↓ + 2 HF
С последующим:
- 2 H 2 [NbOF 5 ] + 10 NH 4 OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Для восстановления до металлического ниобия используется несколько методов . Электролизе расплавленной смеси K 2 [NbOF 5 ] и хлорида натрия является одним; другой – восстановление фторида натрием . С помощью этого метода можно получить ниобий относительно высокой чистоты. При крупномасштабном производстве Nb 2 O 5 восстанавливают водородом или углеродом. В алюмотермической реакции смесь оксида железа и оксида ниобия реагирует с алюминием :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Для усиления реакции добавляют небольшие количества окислителей, таких как нитрат натрия . В результате получается оксид алюминия и феррониобий , сплав железа и ниобия, используемый в производстве стали. Феррониобий содержит от 60 до 70% ниобия. Без оксида железа для производства ниобия используется алюминотермический процесс. Для получения класса сверхпроводящих сплавов необходима дополнительная очистка . Электронно-лучевая плавка в вакууме – метод, используемый двумя основными распространителями ниобия.
По состоянию на 2013 год CBMM из Бразилии контролировал 85 процентов мирового производства ниобия. По оценкам Геологической службы США, производство увеличилось с 38 700 тонн в 2005 году до 44 500 тонн в 2006 году. Мировые ресурсы оцениваются в 4,4 миллиона тонн. За десятилетний период с 1995 по 2005 год производство увеличилось более чем вдвое, начиная с 17 800 тонн в 1995 году. В период с 2009 по 2011 год производство было стабильным на уровне 63 000 тонн в год с небольшим снижением в 2012 году до 50 000 тонн в год. .
| Страна | 2000 г. | 2001 г. | 2002 г. | 2003 г. | 2004 г. | 2005 г. | 2006 г. | 2007 г. | 2008 г. | 2009 г. | 2010 г. | 2011 г. | 2012 г. | 2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Австралия | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | ? | ? |
| Бразилия | 30 000 | 22 000 | 26 000 | 29 000 | 29 900 | 35 000 | 40 000 | 57 300 | 58 000 | 58 000 | 58 000 | 58 000 | 45 000 | 53 100 |
| Канада | 2290 | 3 200 | 3 410 | 3 280 | 3 400 | 3 310 | 4 167 | 3020 | 4380 | 4330 | 4 420 | 4 630 | 4,710 | 5 260 |
| Конго ДР | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | ? | ? |
| Мозамбик | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | ? | ? |
| Нигерия | 35 год | 30 | 30 | 190 | 170 | 40 | 35 год | ? | ? | ? | ? | ? | ? | ? |
| Руанда | 28 год | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | ? | ? |
| Мир | 32 600 | 25 600 | 29 900 | 32 800 | 34 000 | 38 700 | 44 500 | 60 400 | 62 900 | 62 900 | 62 900 | 63 000 | 50 100 | 59 400 |
Меньшие количества находятся на месторождении Каньяка в Малави ( рудник Каньяка ).
Химические свойства V, Nb, Ta
Ванадий является более активным металлом, чем ниобий и тантал, но менее, чем титан. Из кислот-неокислителей, ванадий вступает в реакцию только с плавиковой кислотой:
2V+12HF = 2H3[VF6]+3H2↑
С горячим раствором концентрированной серной кислоты ванадий окисляется до соединений ванадила:
2V+12HF = 2H3[VF6]+3H2↑
Азотная кислота с плотностью выше 1,35 г/см3 окисляет и растворяет ванадий:
V+3H2SO4 = VOSO4+2SO2↑+3H2O
Полностью окисляют ванадий до высших степеней окисления хлорная, хлорноватая, бромноватая, йодноватая и пероксодисерная кислоты: HClO4, HClO3, HBrO3, HIO3, H2S2O8. Лучше всего ванадий растворяют царская водка и смесь азотной и плавиковой кислоты. При н.у. ванадий практически не окисляется на воздухе, не реагирует с растворами органических кислот и щелочей.
Реакционная активность ванадия повышается по мере роста температуры – порошок ванадия при нагревании на воздухе воспламеняется. С азотом при температуре 1000°C ванадий образует нитрид VN, с водородом – гидрид VH (500-900°C). Легче всего ванадий реагирует с галогенами, образуя при нагревании фториды (VF5), тетрахлориды (VCl4), трибромиды (VBr3), дииодиды (VI2).
Ниобий, и в большей степени тантал, еще менее склонны вступать в реакции с другими веществами, что объясняется наличием прочной защитной оксидной пленки на их поверхности. При н.у. ниобий медленно реагирует только со смесью азотной и плавиковой кислот, а тантал вообще с кислотами не реагирует. Даже при нагревании до температуры красного каления на воздухе слитки ниобия и тантала только тускнеют с поверхности. Измельченные в порошок ниобий и тантал при нагревании до 900°C сгорают в кислороде, мелкоизмельченный ниобий воспламеняется в расплавленной селитре. С галогенами ниобий и тантал взаимодействуют при нагревании до высоких температур. Также при значительном нагревании тантал и ниобий реагируют с серой, углеродом, аммиаком, азотом, сероводородом, водородом (реакция обратима).
использовать
Сверхпроводящий резонатор из ниобия высокой чистоты для лазера на свободных электронах в DESY .
Ниобий используется в качестве легирующей добавки для нержавеющих сталей, специальных нержавеющих сталей (например, труб для производства соляной кислоты) и цветных сплавов, поскольку легированные ниобием материалы характеризуются повышенной механической прочностью. Даже в концентрациях от 0,01 до 0,1 процента по массе ниобий в сочетании с термомеханической прокаткой может значительно повысить прочность и ударную вязкость стали. Первые попытки использовать ниобий в качестве легирующего элемента (замены вольфрама ) были предприняты в США в 1925 году. Обработанные таким образом стали часто используются при строительстве трубопроводов. В качестве сильного карбидообразователя ниобий также добавляют в сварочные материалы для связывания углерода.
Монета Австрия штамп 25 евро биметаллических с сердцевиной ниобия.
Другое использование:
- Применение в ядерной технологии из – за низкий сечение захвата для тепловых нейтронов .
- Производство сварочных электродов, стабилизированных ниобием, в качестве присадочных материалов для нержавеющих сталей , специальных нержавеющих сталей и сплавов на никелевой основе .
- Из-за своего голубоватого цвета он используется для пирсинга ювелирных изделий и изготовления ювелирных украшений.
- В алюминиевых сплавах он используется для производства легких, но жестких компонентов и транспортных средств, таких как обода велосипедов.
- В случае монет с ниобием (биметаллические монеты) цвет ядра ниобия может сильно различаться из-за физических процессов (например, для монет за 25 евро из Австрии).
Черная часть сопла ракеты изготовлена из ниобий-титанового сплава.
- Значительные количества феррониобов и ниобов никеля используются в металлургической промышленности для производства жаропрочных сплавов (никель, кобальт и сплавы на основе железа). Из него изготавливаются статические детали для стационарных и летающих газовых турбин, детали ракет и жаропрочные детали для печного строительства.
- Ниобий используется в качестве анодного материала в ниобиевых электролитических конденсаторах . Оксид ниобия, оксид ниобия (V), обладает высокой диэлектрической прочностью. Он наносится на поверхность ниобиевого анода в так называемом процессе формования и служит диэлектриком в этом конденсаторе. Ниобиевые электролитические конденсаторы конкурируют с более популярными танталовыми электролитическими конденсаторами .
- Стеклянные колбы галогенных ламп снаружи с буквой z. B. niobium, часть теплового излучения вольфрамовой нити отражается обратно внутрь. В результате может быть достигнута более высокая рабочая температура и, следовательно, большая световая отдача при меньшем потреблении энергии.
- В качестве катализатора (например, при производстве соляной кислоты, при синтезе биодизельного топлива и при производстве спиртов из бутадиена).
- Как ниобат калия (химическое соединение калия, ниобия и кислорода), который используется в качестве монокристалла в лазерной технологии и для нелинейных оптических систем.
- Использование в качестве электродного материала для
- Сверхпроводимость : При температурах ниже 9,5 К, чистый ниобий является типом II , сверхпроводник сплавы ниобия (с N, O, Sn, Alge, Ge) принадлежит к. Типу II веществ в дополнении к чистым элементам ниобию, ванадий и технеций -Superconductors является : Температура перехода этих сплавов составляет от 18,05 К ( ниобий-олово Nb 3 Sn) до 23,2 К ( ниобий-германий Nb 3 Ge). Сверхпроводящие объемные резонаторы из ниобия используются в ускорителях частиц (включая XFEL и в DESY в Гамбурге). – Для создания сильных магнитных полей до 20 Тесла используются сверхпроводящие магнитные катушки с проводами из ниобий-олова или ниобий-титана, например Б. в термоядерном реакторе ИТЭР 600 т ниобий-олово и 250 т ниобий-титан. Катушки сверхпроводящего магнита LHC также сделаны из сплавов ниобия.
- Благодаря своей биосовместимости ниобий используется для поверхностного покрытия имплантатов.
- Чтобы противодействовать межкристаллитной коррозии , ниобий используется в качестве легирующего элемента в хромистых сталях. Для этого он должен присутствовать как минимум в двенадцатикратной концентрации углерода. Ниобий образует карбиды быстрее, чем хром. Следовательно, не происходит образования богатых хромом карбидов, что означало бы, что обедненные хромом области развиваются в другом месте структуры.
Свойства и особенности производства
Образец чистого металла был изготовлен в 1864 году Кристианом Бломстрандом, который восстановил хлорид ниобия, нагревая его газообразным водородом. Почти весь Nb добывается в Бразилии и Канаде. Предполагается, что промышленное его количество в земной коре сохранится в течение следующих пяти веков. Согласно исследованиям, некоторые соединения ниобиевой пыли могут вызывать раздражение глаз и кожи, тем не менее, не зафиксированы какие-либо серьезные последствия при работе с Nb, так же как и негативного влияния его на экологию.
Элемент встречается в виде оксида и обладает сильной геохимической связью с танталом. Основные минералы — пирохлор и колумбит , состоящий из ниобата, танталата, железа и марганца. Пирохлор встречается обычно в карбонатитах и пегматитах, полученных из щелочных пород, связанных с минералами циркония, титана, тория, урана и редкоземельных элементов. Колумбит содержится в интрузивных пегматитах и биотитах, а также в щелочных гранитах. Однако, поскольку большинство таких месторождений невелики и распределены неравномерно на земле, они получаются, как побочный продукт других металлов.
Металл добывают открытым способом, руда, делится на блоки и перерабатывается путем разрыва, с помощью бульдозера, погрузки и транспортировки. Добыча в Квебеке (Канада) идет подземными методами. Концентрация руды достигается путем дробления и измельчения, магнитного разделения для удаления магнетита, а затем обесшламливания и флотационного разделения.
Концентрат пирохлора обычно восстановлен до феррониобия через алюминотермический процесс. Он смешивается с гематитом, алюминиевым порошком и небольшим количеством флюорошпатового и известкового флюсов в роторном смесителе. Затем выгружается в стальные контейнеры, облицованные огнеупорным кирпичом из магнезита.
Здесь смесь помещается в круглые углубления, сделанные из смеси извести, плавикового шпата и кварцевого песка, и восстанавливается воспламенением смеси алюминиевого порошка и хлората натрия или пероксида бария. Экзотермическая реакция длится примерно от 15 до 30 минут, а температура процесса порядка 2400 C. Большая часть примесей из концентрата, включая все оксиды тория и урана, попадают в расплавленный шлак, Когда реакция заканчивается, он отводится, и сосуд поднимается, оставляя металл остывать в песке.
Сплав товарного феррониобия измельчают до размеров частиц с составом:
- Nb – 62–69%;
- железа – 29–30%;
- кремния – 2%;
- алюминия – 1–3%.
Получение
Руды ниобия — обычно комплексные и бедны металлом. Рудные концентраты содержат Nb2O5: пирохлоровые — не менее 37 %, лопаритовые — 8 %, колумбитовые — 30—60 %. Большую их часть перерабатывают алюмо- или силикотермическим восстановлением на феррониобий (40—60 % Nb) и ферротанталониобий. Металлический ниобий получают из рудных концентратов по сложной технологии в три стадии:
- вскрытие концентрата,
- разделение ниобия и тантала и получение их чистых химических соединений,
- восстановление и рафинирование металлического ниобия и его сплавов.
Основные промышленные методы производства ниобия и его сплавов — алюмотермический, натрийтермический, карботермический: из смеси Nb2O5 и сажи вначале получают при 1800 °C в атмосфере водорода карбид, затем из смеси карбида и пятиокиси при 1800—1900 °C в вакууме — металл; для получения сплавов ниобия в эту смесь добавляют окислы легирующих металлов; по другому варианту ниобий восстанавливают при высокой температуре в вакууме непосредственно из Nb2O5 сажей. Натрийтермическим способом ниобий восстанавливают натрием из K2NbF7, алюминотермическим — алюминием из Nb2O5. Компактный металл (сплав) производят методами порошковой металлургии, спекая спрессованные из порошков штабики в вакууме при 2300 °C либо электронно-лучевой и вакуумной дуговой плавкой; монокристаллы ниобия высокой чистоты — бестигельной электронно-лучевой зонной плавкой.
Как они образовались?
Влажность и рН напрямую влияют на окисление металлов в их соответствующих оксидах. Наличие СО2, Оксид кислоты может быть достаточно растворен в воде, которая покрывает металлическую часть, чтобы ускорить введение кислорода в анионной форме в кристаллическую структуру металла..
Эту реакцию также можно ускорить с повышением температуры, особенно когда желательно получить оксид за короткое время..
Прямая реакция металла с кислородом
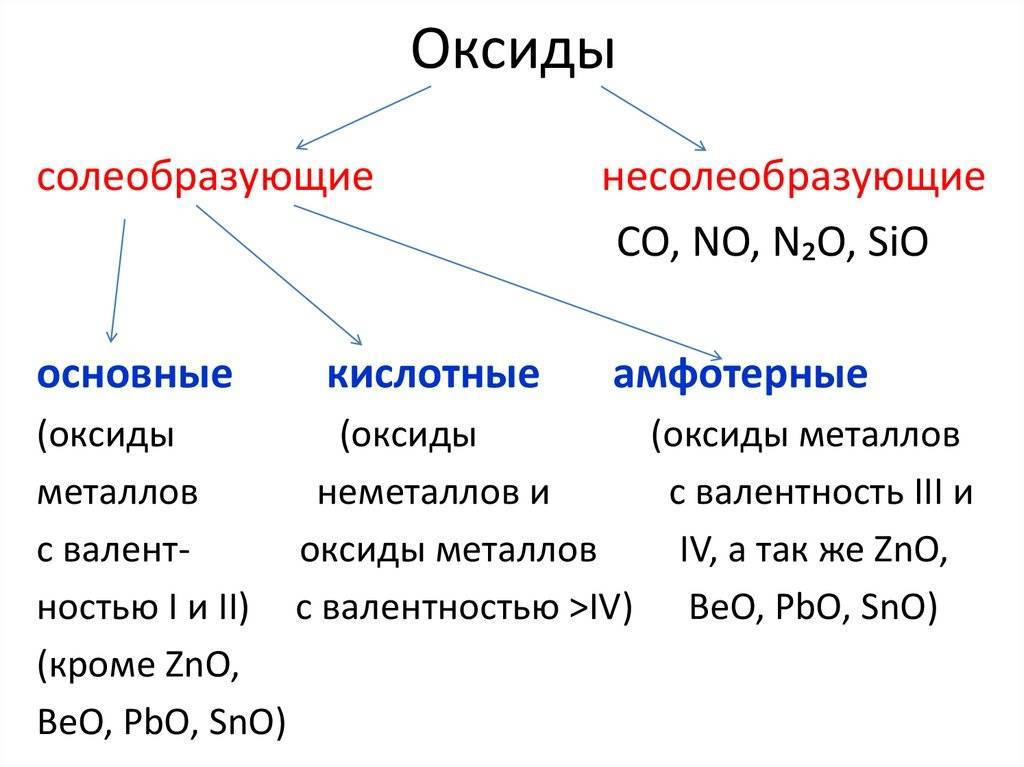
Оксиды металлов образуются как продукт реакции между металлом и окружающим кислородом. Это может быть представлено с помощью химического уравнения ниже:
2M (s) + O2(г) => 2MO (s)
Эта реакция медленная, так как кислород имеет сильную двойную связь O = O и электронный перенос между ним и металлом неэффективен.
Тем не менее, он значительно ускоряется с увеличением температуры и площади поверхности. Это связано с тем, что энергия, необходимая для разрыва двойной связи O = O, обеспечивается, и, поскольку существует большая площадь, кислород равномерно движется по всему металлу, одновременно сталкиваясь с атомами металла..
Чем больше количество реагента кислорода, тем больше валентность или степень окисления, возникающая для металла. Почему? Поскольку кислород захватывает все больше электронов из металла, пока он не достигнет максимальной степени окисления.
Это можно увидеть, например, для меди. Когда кусок металлической меди реагирует с ограниченным количеством кислорода, образуется медь2O (оксид меди (I), оксид меди или двуокись диоксида):
4Cu (s) + O2(г) + Q (тепло) => 2Cu2O (s) (красное твердое вещество)
Но когда он реагирует в эквивалентных количествах, получается CuO (оксид меди (II), оксид меди или оксид меди):
2Cu (s) + O2(г) + Q (нагрев) => 2CuO (s) (сплошной черный цвет)
Реакция солей металлов с кислородом
Оксиды металлов могут образовываться в результате термического разложения. Чтобы это было возможно, одна или две маленькие молекулы должны быть освобождены от исходного соединения (соли или гидроксида):
М (ОН)2 + Q => МО + Н2О
MCO3 + Q => MO + CO2
2 М (НЕТ3)2 + Q => МО + 4НО2 + О2
Обратите внимание, что H2O, CO2, НЕТ2 и O2 высвобождаются ли молекулы
использовать
Сверхпроводящий резонатор из ниобия высокой чистоты для лазера на свободных электронах в DESY .
Ниобий используется в качестве легирующей добавки для нержавеющих сталей, специальных нержавеющих сталей (например, труб для производства соляной кислоты) и цветных сплавов, поскольку легированные ниобием материалы характеризуются повышенной механической прочностью. Даже в концентрациях от 0,01 до 0,1 процента по массе ниобий в сочетании с термомеханической прокаткой может значительно повысить прочность и ударную вязкость стали. Первые попытки использовать ниобий в качестве легирующего элемента (замены вольфрама ) были предприняты в США в 1925 году. Обработанные таким образом стали часто используются при строительстве трубопроводов. В качестве сильного карбидообразователя ниобий также добавляют в сварочные материалы для связывания углерода.
Монета Австрия штамп 25 евро биметаллических с сердцевиной ниобия.
Другое использование:
- Применение в ядерной технологии из – за низкий сечение захвата для тепловых нейтронов .
- Производство сварочных электродов, стабилизированных ниобием, в качестве присадочных материалов для нержавеющих сталей , специальных нержавеющих сталей и сплавов на никелевой основе .
- Из-за своего голубоватого цвета он используется для пирсинга ювелирных изделий и изготовления ювелирных украшений.
- В алюминиевых сплавах он используется для производства легких, но жестких компонентов и транспортных средств, таких как обода велосипедов.
- В случае монет с ниобием (биметаллические монеты) цвет ядра ниобия может сильно различаться из-за физических процессов (например, для монет за 25 евро из Австрии).
Черная часть сопла ракеты изготовлена из ниобий-титанового сплава.
- Значительные количества феррониобов и ниобов никеля используются в металлургической промышленности для производства жаропрочных сплавов (никель, кобальт и сплавы на основе железа). Из него изготавливаются статические детали для стационарных и летающих газовых турбин, детали ракет и жаропрочные детали для печного строительства.
- Ниобий используется в качестве анодного материала в ниобиевых электролитических конденсаторах . Оксид ниобия, оксид ниобия (V), обладает высокой диэлектрической прочностью. Он наносится на поверхность ниобиевого анода в так называемом процессе формования и служит диэлектриком в этом конденсаторе. Ниобиевые электролитические конденсаторы конкурируют с более популярными танталовыми электролитическими конденсаторами .
- Стеклянные колбы галогенных ламп снаружи с буквой z. B. niobium, часть теплового излучения вольфрамовой нити отражается обратно внутрь. В результате может быть достигнута более высокая рабочая температура и, следовательно, большая световая отдача при меньшем потреблении энергии.
- В качестве катализатора (например, при производстве соляной кислоты, при синтезе биодизельного топлива и при производстве спиртов из бутадиена).
- Как ниобат калия (химическое соединение калия, ниобия и кислорода), который используется в качестве монокристалла в лазерной технологии и для нелинейных оптических систем.
- Использование в качестве электродного материала для
- Сверхпроводимость : При температурах ниже 9,5 К, чистый ниобий является типом II , сверхпроводник сплавы ниобия (с N, O, Sn, Alge, Ge) принадлежит к. Типу II веществ в дополнении к чистым элементам ниобию, ванадий и технеций -Superconductors является : Температура перехода этих сплавов составляет от 18,05 К ( ниобий-олово Nb 3 Sn) до 23,2 К ( ниобий-германий Nb 3 Ge). Сверхпроводящие объемные резонаторы из ниобия используются в ускорителях частиц (включая XFEL и в DESY в Гамбурге). – Для создания сильных магнитных полей до 20 Тесла используются сверхпроводящие магнитные катушки с проводами из ниобий-олова или ниобий-титана, например Б. в термоядерном реакторе ИТЭР 600 т ниобий-олово и 250 т ниобий-титан. Катушки сверхпроводящего магнита LHC также сделаны из сплавов ниобия.
- Благодаря своей биосовместимости ниобий используется для поверхностного покрытия имплантатов.
- Чтобы противодействовать межкристаллитной коррозии , ниобий используется в качестве легирующего элемента в хромистых сталях. Для этого он должен присутствовать как минимум в двенадцатикратной концентрации углерода. Ниобий образует карбиды быстрее, чем хром. Следовательно, не происходит образования богатых хромом карбидов, что означало бы, что обедненные хромом области развиваются в другом месте структуры.
Свойства ниобия (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Ниобий |
| 102 | Прежнее название | Колумбий |
| 103 | Латинское название | Niobium |
| 104 | Английское название | Niobium |
| 105 | Символ | Nb |
| 106 | Атомный номер (номер в таблице) | 41 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Чарльз Хэтчет, Великобритания, 1801 г. |
| 110 | Год открытия | 1801 г. |
| 111 | Внешний вид и пр. | Блестящий металл серебристо-серого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0017 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10-10 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 2,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000019 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 92,90638(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d4 5s1 |
| 203 | Электронная оболочка | K2 L8 M18 N12 O1 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 164 пм |
| 205 | Эмпирический радиус атома* | 145 пм |
| 206 | Ковалентный радиус* | 137 пм |
| 207 | Радиус иона (кристаллический) | Nb3+ 86 (6) пм, Nb4+ 82 (6) пм, Nb5+ 78 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 41 электрон, 41 протон, 52 нейтрона |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 5-ая группа (по старой классификации – побочная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3, -1, +1, +2, +3, +4, +5 |
| 302 | Валентность | I, II, III, IV, V |
| 303 | Электроотрицательность | 1,6 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 652,13 кДж/моль (6,75885(4) эВ) |
| 305 | Электродный потенциал | Nb3+ + 3e– → Nb, Eo = -1,1 В |
| 306 | Энергия сродства атома к электрону | 86,1 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность | 8,57 г/см3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 2477 °C (2750 K, 4491 °F) |
| 403 | Температура кипения* | 4742 °С (5015 K, 8567 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 30 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 689,9 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,265 Дж/г·K (при 25 °C), 0,322 Дж/г·K (при 1000 °C) |
| 410 | Молярная теплоёмкость* | 24,44 Дж/(K·моль) |
| 411 | Молярный объём | 10,8 см³/моль |
| 412 | Теплопроводность | 53,7 Вт/(м·К) (при стандартных условиях), 53,7 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная |
| 513 | Параметры решётки | 3,301 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 275 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-03-1 |
Примечание:
205* Эмпирический радиус атома ниобия согласно и составляет 146 пм.
206* Ковалентный радиус ниобия согласно и составляет 164±6 пм и 164 пм соответственно.
402* Температура плавления ниобия согласно и составляет 2468 °С (2741 K, 4474 °F) и 2470 °С (2743,15 K, 4478 °F) соответственно.
403* Температура кипения ниобия согласно и составляет 4742 °С (5015 K, 8567 °F) и 4760 °С (5033,15 K, 8600 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) ниобия согласно и составляет 26,8 кДж/моль и 28 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) ниобия согласно и составляет 680 кДж/моль и 662 кДж/моль соответственно.
410* Молярная теплоёмкость ниобия согласно составляет 24,44 Дж/(K·моль).