Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Смотреть галерею
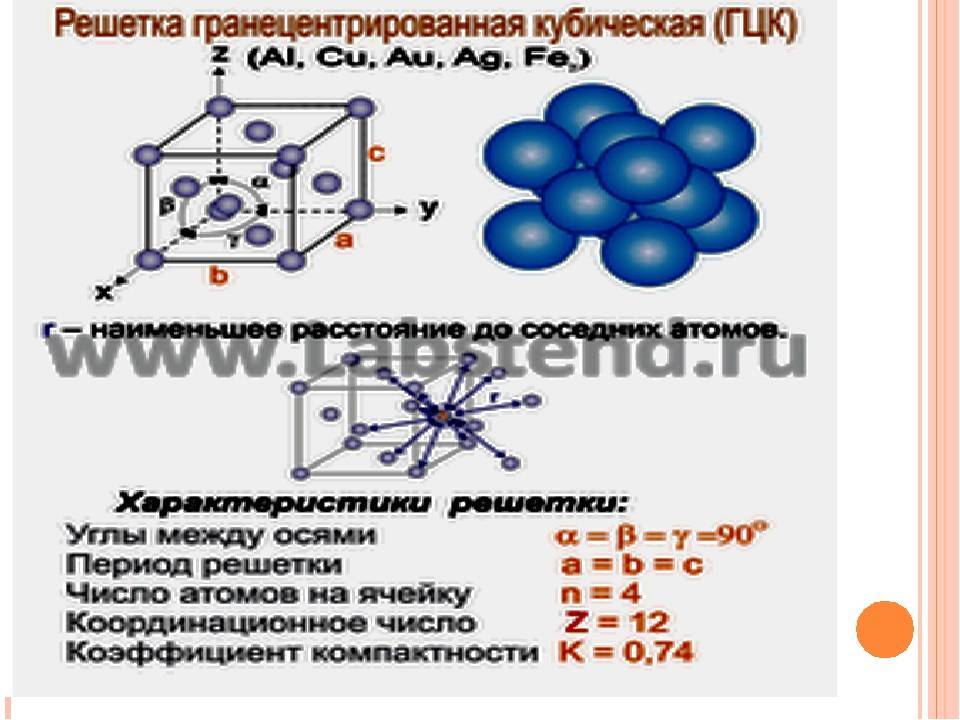
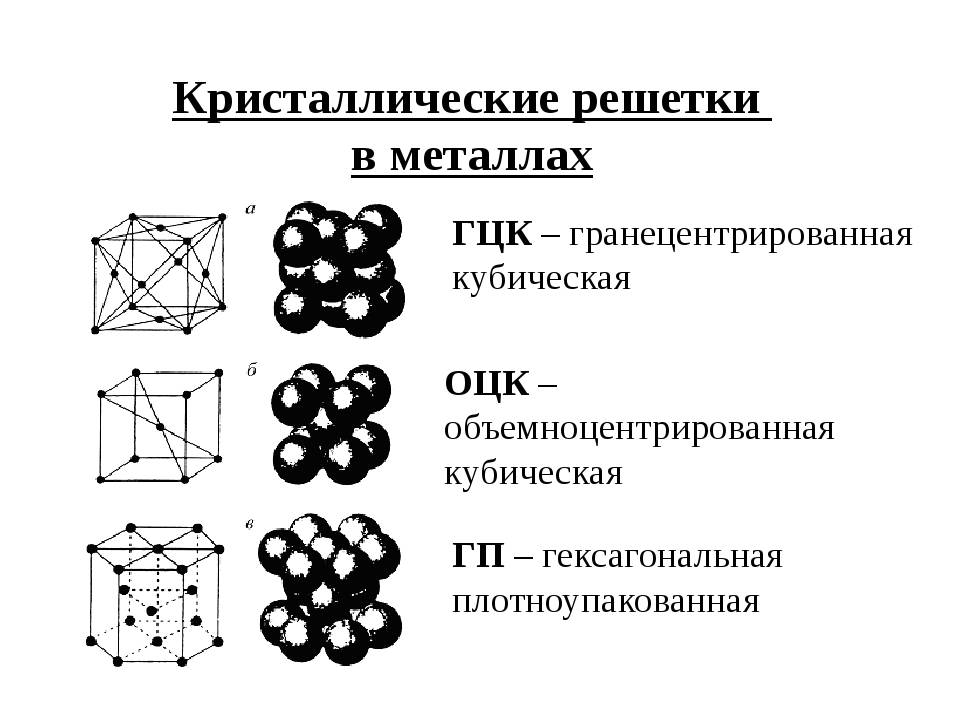
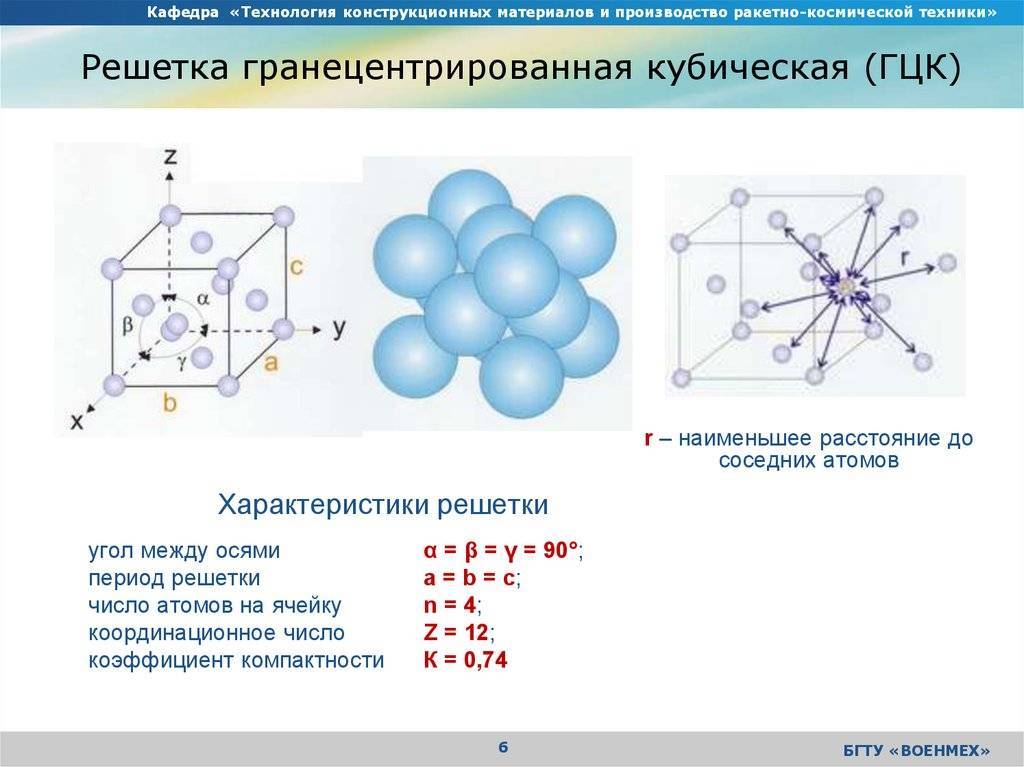
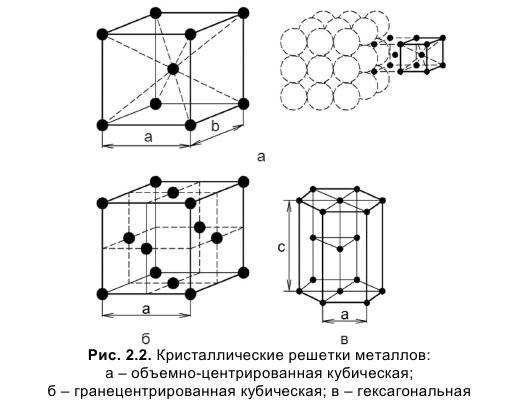
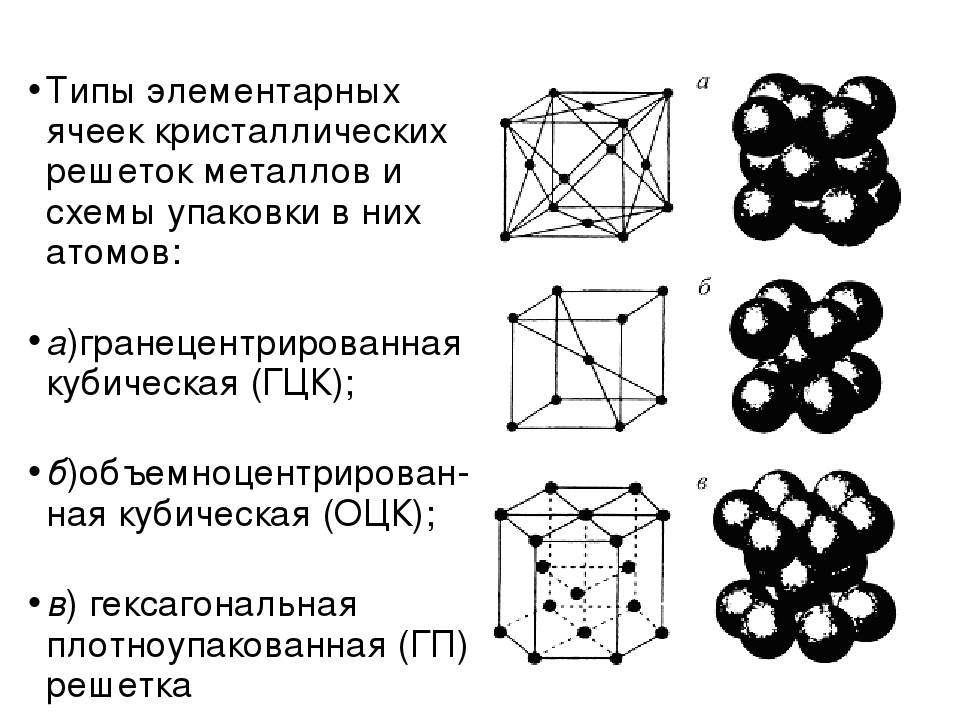
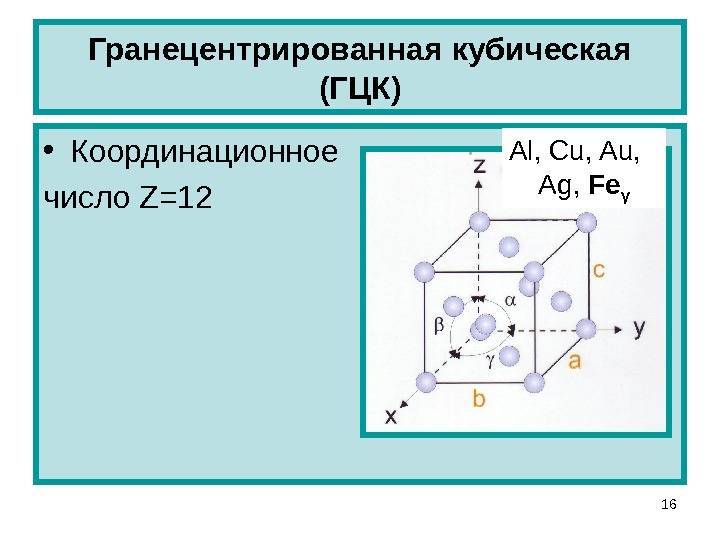
Гранецентрированная кубическая решетка
Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводностью и теплопроводностью, исключительно пластичен.
Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью, исключительно пластичен.
Например, гранецентрированной кубической решетке принадлежат только четыре атома, а не 14, как может показаться на первый взгляд.
Металлы с гранецентрированной кубической решеткой ( медь, никель, алюминий, аустенитные стали с высоким содержанием никеля) сохраняют свою пластичность при температуре жидкого кислорода. Металлы с объемно центрированной решеткой ( углеродистые стали, магний, вольфрам и др.) становятся в этих условиях хрупкими.
Металлы с гранецентрированной кубической решеткой ( медь, алюминий, никель, свинец, – железо, аустенитные стали) с понижением температуры сохраняют пластичность, у них увеличиваются пределы текучести и прочности, повышается твердость и уменьшается ударная вязкость. Металлы с объемноцентрированной кубической решеткой ( а-железо, вольфрам, магний, цинк, феррит-ные стали, чугун и др.) при низких температурах становятся хрупкими.
Металлы с гранецентрированной кубической решеткой ( медь, никель, алюминий, аустенитные стали с высоким содержанием никеля) сохраняют свою пластичность при температуре жидкого кислорода. Металлы с объемно-центрированной решеткой ( углеродистые стали, магний, вольфрам и др.) становятся в этих условиях хрупкими.
Медь обладает гранецентрированной кубической решеткой. Это металл красного ( в изломе розового) цвета, ковкий и мягкий; плотность 8960 кг / м3, / пл 1083 С. Химически она малоактивна; в атмосфере, содержащей СО2, пары Н2О и др., покрывается патиной.
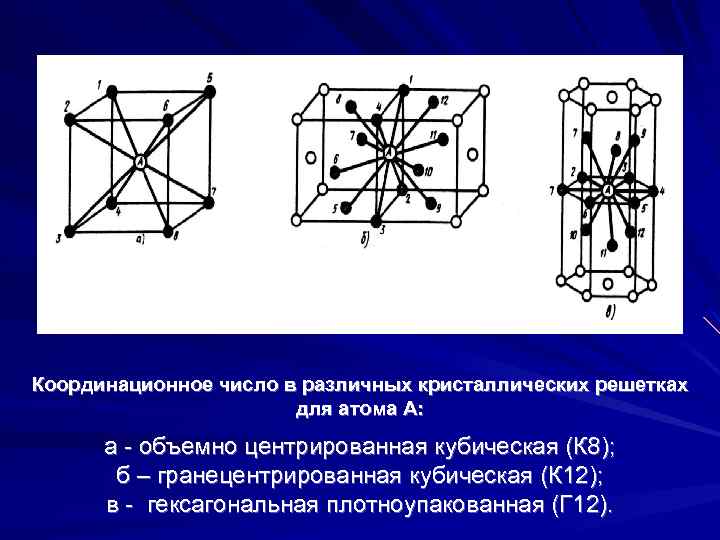
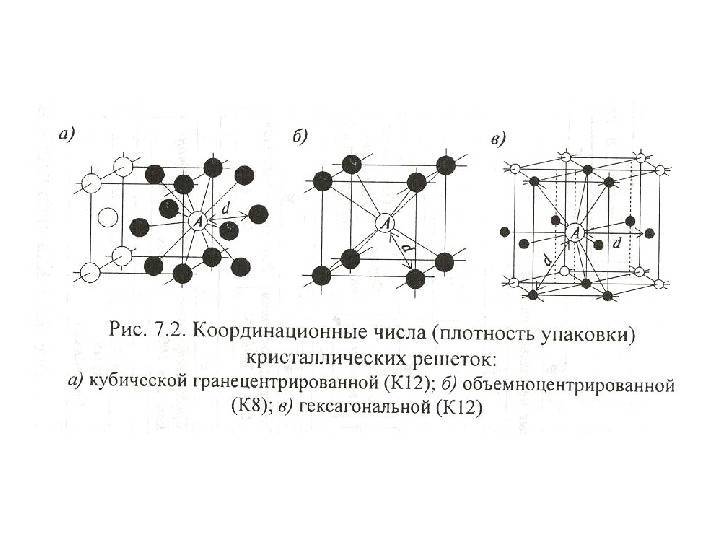
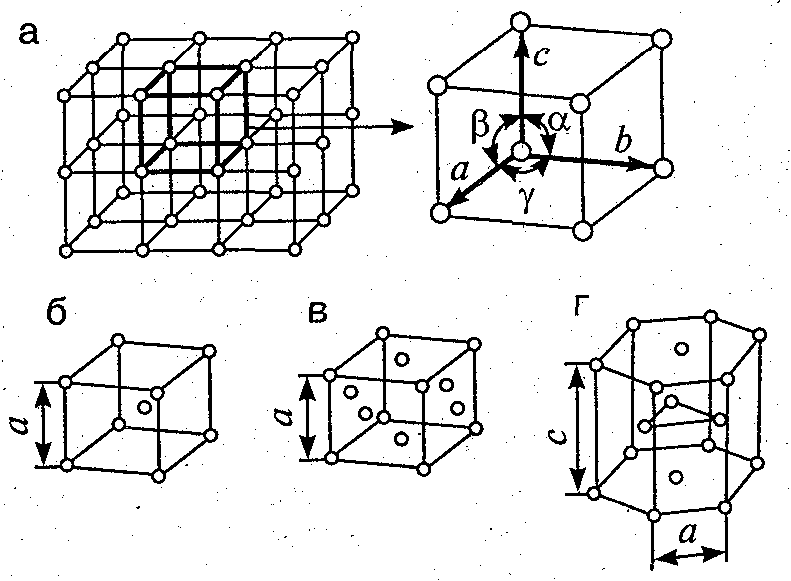
| Кристаллические решетки металлов. а – объемно-центрированная ( ОЦК. б – гранецентрированная ( ГЦК. в – гексагональная ( ГПУ. – ребро куба. – диагональ грани куба. – диагональ куба. – ось симметрии призмы. |
На элементарную ячейку гранецентрированной кубической решетки приходится четыре атома; из них один ( по такому же расчету, как и для объемно центрированной решетки) вносят атомы в вершинах куба, а три суммарно ( 1 / 2×6 3) вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
Если в узлах гранецентрированной кубической решетки поместить шары, то какая доля пространства будет заполнена шарами в случае плотной упаковки. Эта доля называется коэффициентом упаковки.
| Кристаллические решетки металлов. а – объемно-центрированная ( ОЦК. б – гранецешрированная ( ГЦК. в – гексагональная ( ПТУ. – ребро куба. – диагональ грани куба. – диагональ куба. – ось симметрии призмы. |
На элементарную ячейку гранецентрированной кубической решетки приходится четыре атома; из них один ( по такому же расчету, как и для объемно центрированной решетки) вносят атомы в вершинах куба, а три суммарно ( 1 / 2×6 3) вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
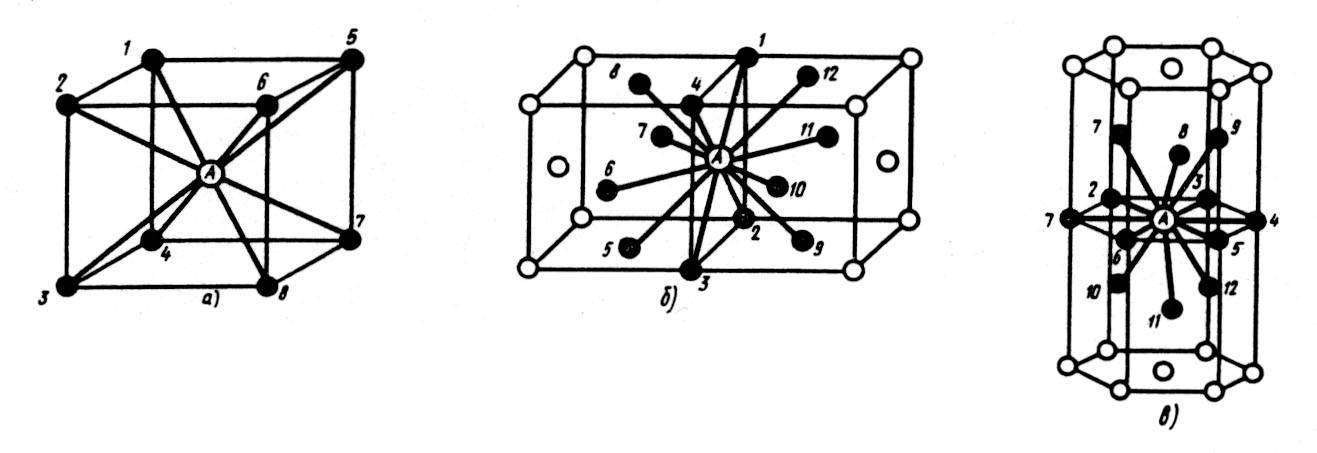
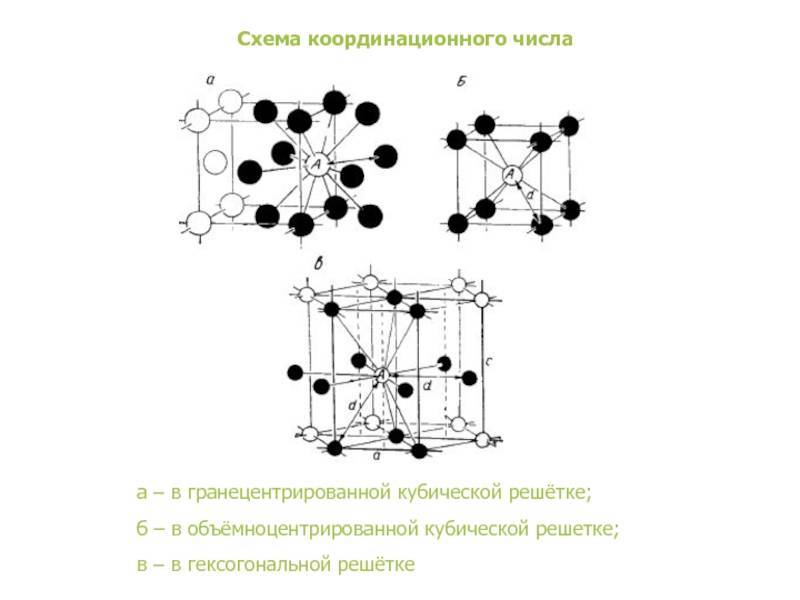
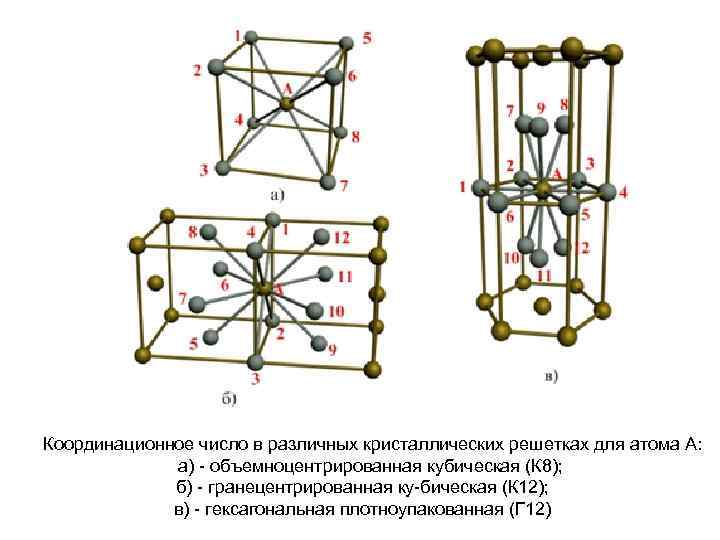
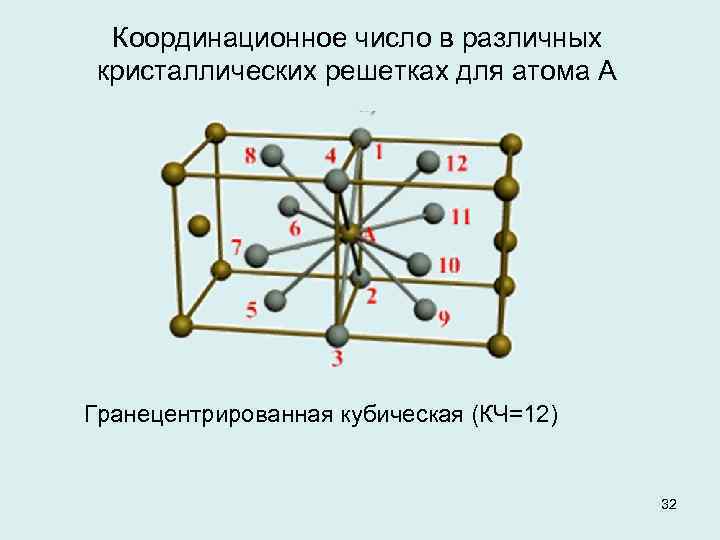
| Схема, показывающая число атомов, находящихся на равном и наименьшем расстоянии от данного атома ( А в различных кристаллических решетках. а – К12. 6 – К8. в – П2 ( С. С. Штейберг. |
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома; из них один атом ( по такому же расчету, как и для объемноцентрированной решетки) вносят атомы, находящиеся в вершинах куба ( YsXS), и три атома вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома: из них один образуется за счет атомов в вершинах куба, а три – суммарная ( 1 / 2 – 6 3) доля атомов, находящихся в серединах граней, так как каждый из этих атомов принадлежит двум ячейкам.
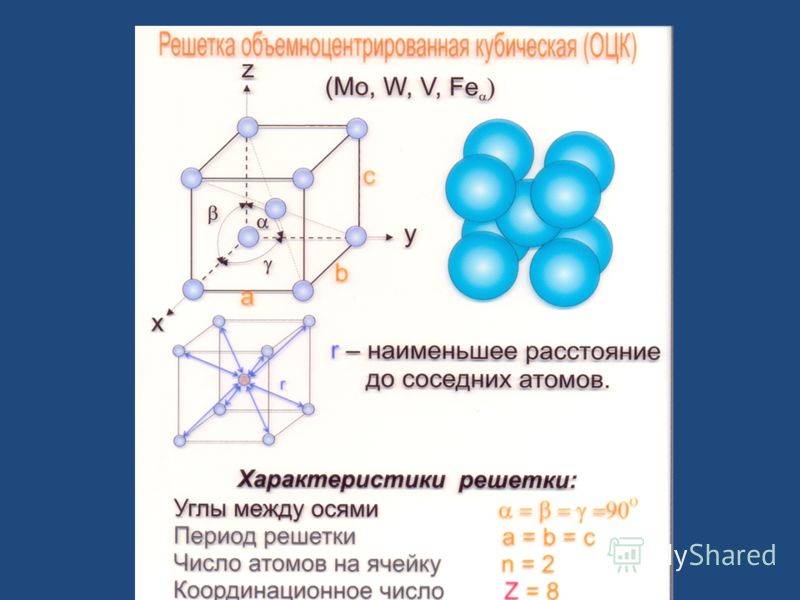
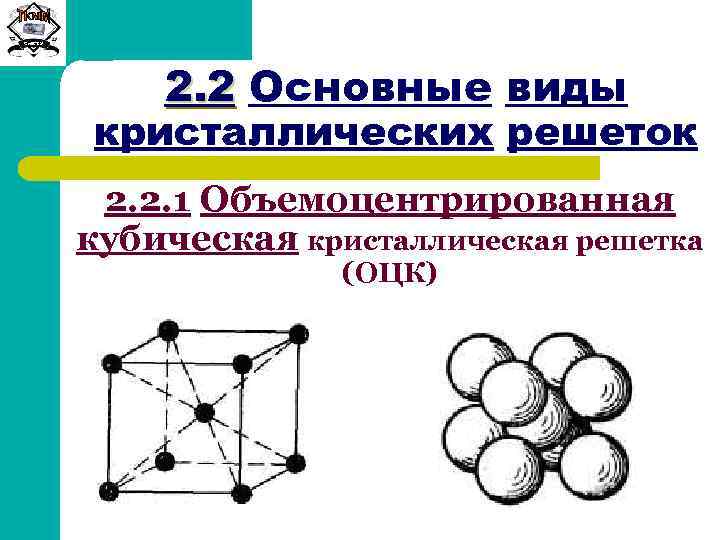
Объемно-центрированная решетка
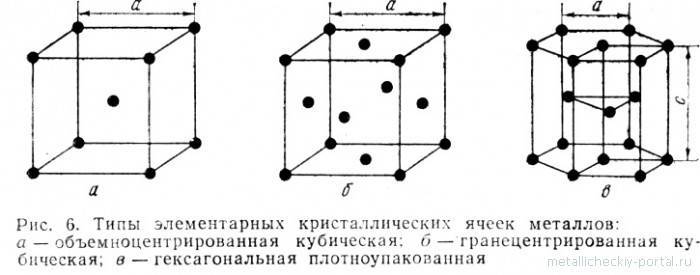
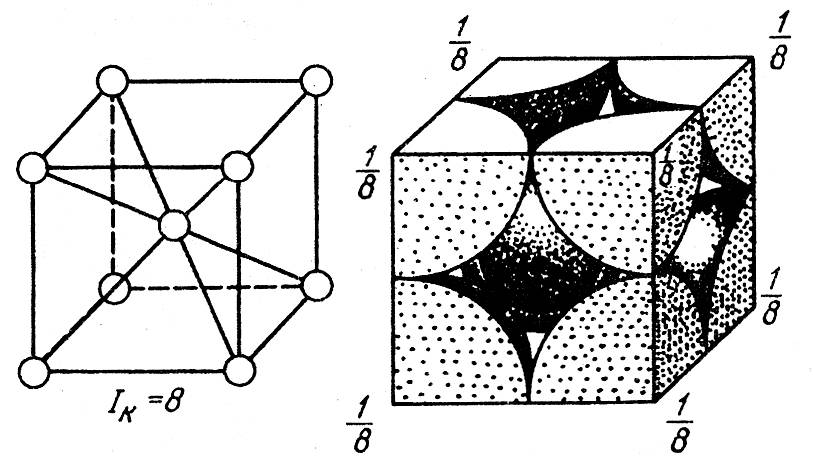
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название «объемно-центрированная».
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей – высокая степень ковкости и пластичности, твердость и прочность.
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Реальный кристалл металла
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
Полиморфизм
Кварц – одна из нескольких кристаллических форм кремнезема SiO 2 . Наиболее важные формы кремнезема включают: α-кварц , β-кварц , тридимит , кристобалит , коэсит и стишовит .
Полиморфизм – это появление нескольких кристаллических форм материала. Он содержится во многих кристаллических материалах, включая полимеры , минералы и металлы . Согласно правилам фазового равновесия Гиббса, эти уникальные кристаллические фазы зависят от интенсивных переменных, таких как давление и температура. Полиморфизм связан с аллотропией , которая относится к элементарным твердым телам . Полная морфология материала описывается полиморфизмом и другими переменными, такими как габитус кристаллов , аморфная фракция или кристаллографические дефекты . Полиморфы обладают разной стабильностью и могут спонтанно и необратимо превращаться из метастабильной формы (или термодинамически нестабильной формы) в стабильную форму при определенной температуре. Они также имеют разные температуры плавления , растворимость и дифрактограммы рентгеновских лучей .
Хорошим примером этого является кварцевая форма диоксида кремния или SiO 2 . В подавляющем большинстве силикатов атом Si имеет тетраэдрическую координацию по 4 атомам кислорода. Все кристаллические формы, кроме одной, включают тетраэдрические звенья {SiO 4 }, связанные вместе общими вершинами в разном расположении. В разных минералах тетраэдры демонстрируют разную степень сетки и полимеризации. Например, они встречаются поодиночке, соединены вместе попарно, в более крупные конечные кластеры, включая кольца, цепочки, двойные цепи, листы и трехмерные каркасы. Минералы классифицируются на группы на основе этих структур. В каждой из 7 термодинамически стабильных кристаллических форм или полиморфов кристаллического кварца только 2 из 4 ребер тетраэдров {SiO 4 } являются общими с другими, что дает чистую химическую формулу кремнезема: SiO 2 .
Другой пример – элементарное олово (Sn), которое является пластичным при температурах окружающей среды, но хрупким при охлаждении. Это изменение механических свойств связано с существованием двух его основных аллотропов , α- и β-олова. Два аллотропа , встречающиеся при нормальном давлении и температуре, α-олово и β-олово, более известны как серое олово и белое олово соответственно. Еще два аллотропа, γ и σ, существуют при температурах выше 161 ° C и давлениях выше нескольких ГПа. Белое олово является металлическим и представляет собой стабильную кристаллическую форму при комнатной температуре или выше. При температуре ниже 13,2 ° C олово существует в серой форме, имеющей кубическую кристаллическую структуру алмаза , подобную алмазу , кремнию или германию . Серое олово вообще не имеет металлических свойств, представляет собой тускло-серый порошкообразный материал и имеет несколько применений, кроме нескольких специализированных полупроводниковых применений. Хотя температура α – β превращения олова номинально составляет 13,2 ° C, примеси (например, Al, Zn и т. Д.) Понижают температуру перехода значительно ниже 0 ° C, и при добавлении Sb или Bi превращение может вообще не происходить.
Периодическая таблица и металлы
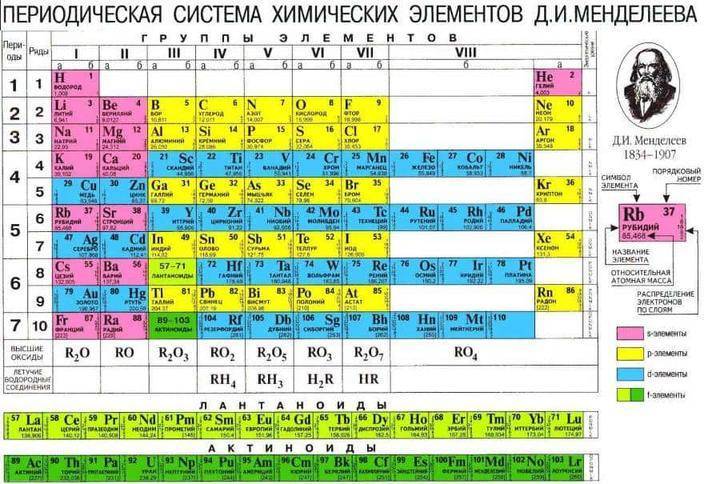
В XIX веке благодаря своему блестящему уму и многим годам труда Дмитрий Иванович Менделеев составил таблицу, собрав в нее все известные на то время химические элементы. Каждому из них в таблице отведено определенное положение в соответствии с числом протонов в атомном ядре. Вся таблица делится на 7 периодов (горизонтальные строки) и 8 групп (вертикальные строки). Чем больше период, тем больше радиус атома соответствующего элемента, и тем на более высоких орбиталях расположены его валентные электроны. Наоборот, чем старше группа (движение по таблице слева направо), тем больше валентных электронов находится на последней орбитали и тем меньше радиус атома.
Любой элемент таблицы можно условно отнести либо к металлам, либо к неметаллам. Металлы расположены по левую сторону от диагонали бор (B) – полоний (Po). Если взглянуть на таблицу, то можно сразу понять, что количество металлов в несколько раз превышает число неметаллов.
Читать также: Как снять кронштейн со стены
Кубическая гранецентрированная решетка
Алюминий является трехвалентным растворителем и имеет кубическую гранецентрированную решетку. Первая зона Брил-люэна у алюминия может вместить только два электрона на атом, и поэтому она должна перекрываться поверхностью Ферми. Однако, как показал Харрисон , степень перекрытия может быть различной, если исходить из сферической формы поверхности Ферми, характерной для свободных электронов. Наличие такого перекрытия у чистого алюминия, очевидно, весьма незначительно отражается на периоде решетки при образовании сплавов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов. При отжиге происходит процесс упорядочения в распределении атомов золота и меди в кристаллической структуре, причем степень упорядочения будет наибольшей для атомных соотношений Си: Аи 3: 1 и Си: Аи 1: 1, отвечающих соединениям Cu3Au и CuAu. Поскольку каждый атом в вершине куба принадлежит одновременно восьми соседним ячейкам, на данную ячейку приходится / 8 атома ill.
Рассмотрим увеличение концентрации свободных электронов в кубической гранецентрированной решетке ограниченного а-твердого раствора при добавлении элемента с более высоким номером группы периодической системы по сравнению с растворителем.
| Гексагональная плотнейшая упаковка. Пример. Mg ( a 3 22. с 5 23 А. |
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Ковкость уменьшается при переходе от кристаллов с кубической гранецентрированной решеткой к металлам с центрированной кубической и гексагональной решетками. Условия, определяющие образование или изменение кристаллической структуры, сильно влияют на ковкость металлов или сплавов. До определенной температуры ковкость растет за счет ослабления связи между кристалликами, а после достижения допустимой максимальной температуры ковкость уменьшается – металлы становятся хрупкими. Это связано с образованием окисных пленок между кристаллами.
Эта формула строго справедлива для кристаллов с кубической гранецентрированной решеткой, однако при применении ее для кристаллов с другими типами решеток погрешность незначительна. Следует учитывать, что такого типа расчеты применимы для монокристаллов. Обычно же имеют дело с поликристаллическими сростками.
В гальванических сплавах Си-Sn наряду с кубической гранецентрированной решеткой меди и тетрагональной решеткой олова обнаружены еще две промежуточные фазы. Рассмотрим более подробно несколько систем.
Структура фтористого кальция показана на рис. 10.4. Это кубическая гранецентрированная решетка.
СМ) 6 атомы железа расположены в узлах кубической гранецентрированной решетки. На рис. 22.5 атомы Fe ( II) представлены заштрихованными кружками, а атомы Fe ( III) – светлыми. На рис. а все атомы железа находятся в трехвалентном состоянии; на рис. б половина атомов – это Fe ( II), а другая половина – Fe ( III); атомы щелочных металлов обеспечивают электронейтралыюсть соединения. Они расположены в центрах чередующихся малых кубов; предполагается, что в гидратированпых соединениях молекулы воды также могут располагаться в пустотах основной сетки. Литий и цезий, представляющие собой соответственно очень малый и очень большой ионы, не дают соединений, имеющих такую структуру. На рис. в все атомы железа находятся в двухвалентном состоянии, и внутри каждого малого куба находится атом щелочного металла. Группы CN располагаются между атомами металла вдоль сплошных линий на рис. 22.5, так что каждый атом переходного металла находится в центре октаэдра из 6 атомов С или 6 атомов N. Таким образом, в целом комплекс состава M / M ( CN) 6 образует простую 6-связанную трехмерную сетку.
| Первая зона ник называется первой зоной Бриллюэна Бриллюэна, симметрич -, х.. |
На рис. 2.6 показана первая зона Бриллюэна для кубической гранецентрированной решетки.
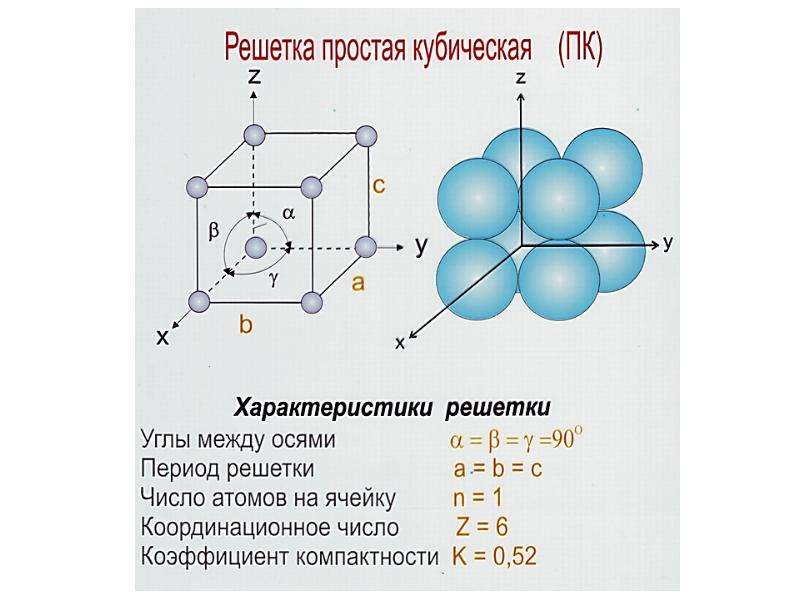
Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение — это науки, которые занимаются изучением особенностей строения таких структур.
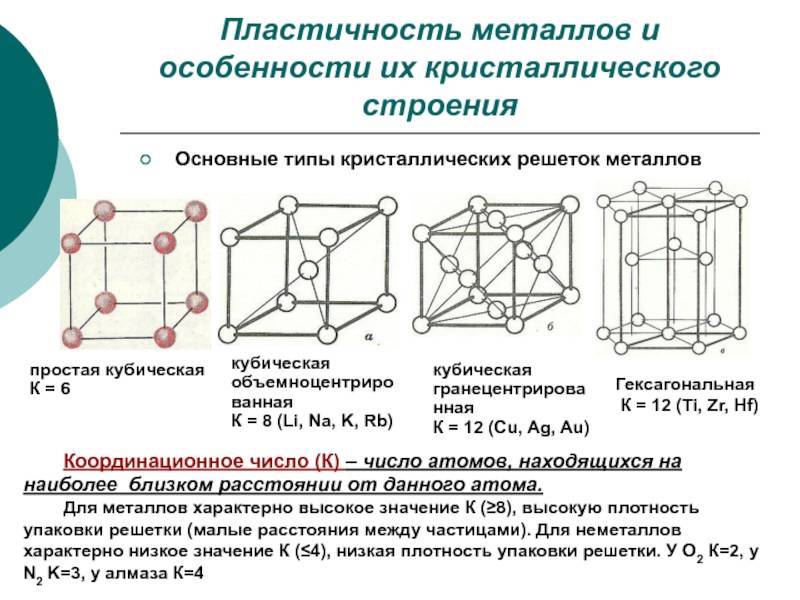
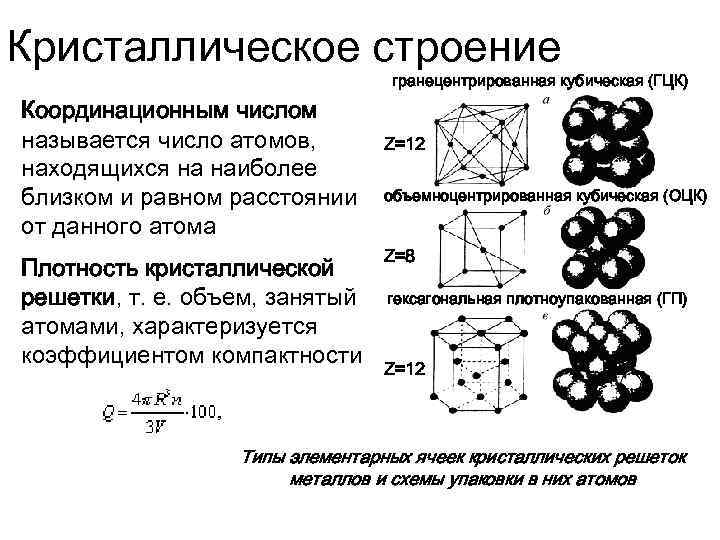
Сама элементарная ячейка — это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность — в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Влияние дефектов на свойства
Как правило, дефекты кристаллического строения металлов приводят к снижению их теплопроводности и электропроводности, материал становится более прочным и менее пластичным. Ярким примером является сталь, которая за счет междоузельных атомов углерода и наличия разных фаз (цементита, графита) в кристаллической решетке железа, значительно прочнее, чем чистый металл.
С развитием нанотехнологий влияние дефектов на свойства металлов может быть неоднозначным. Так, с уменьшением размера зерна может наблюдаться увеличение пластичности материала, что связано с появлением совершенно иного механизма пластической деформации – зернограничного проскальзывания, которое по своей сути отличается от дислокационного.
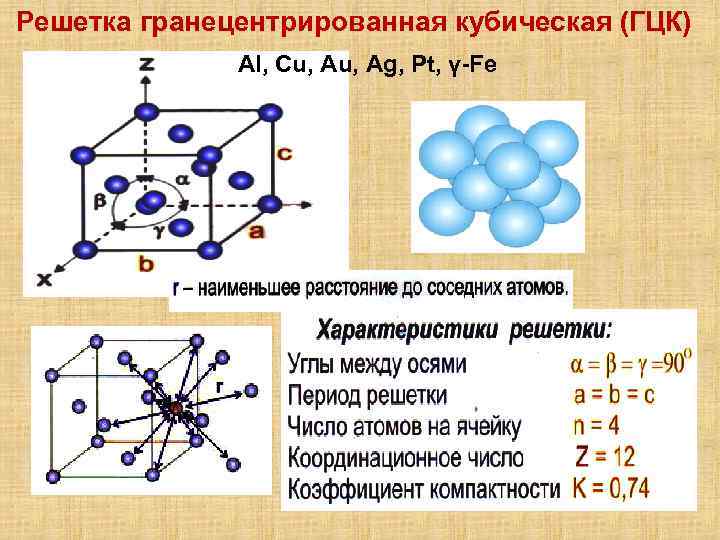
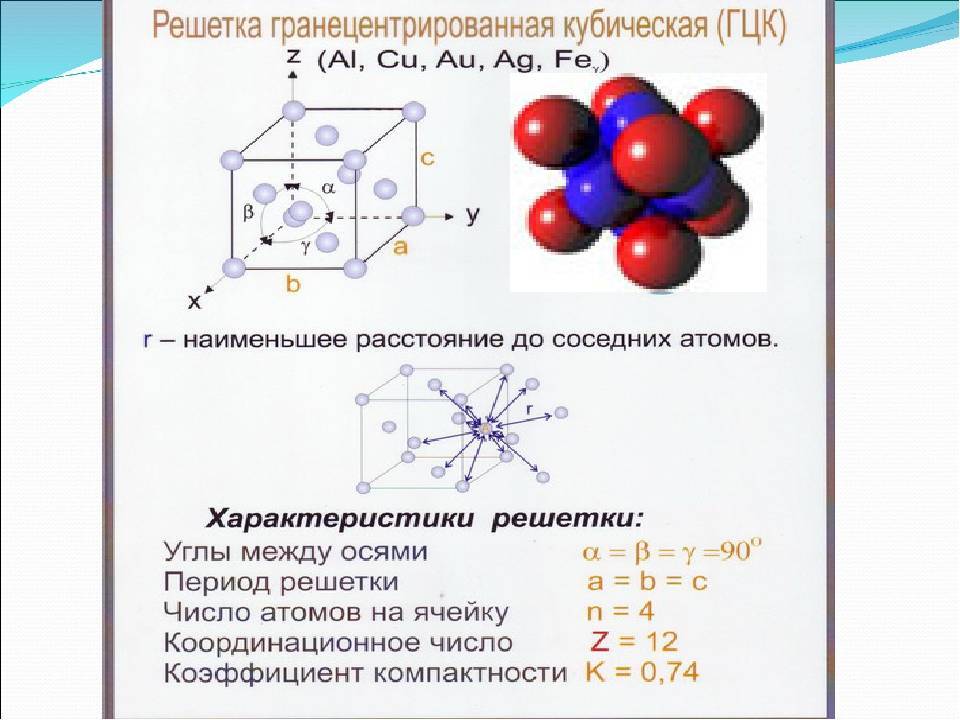
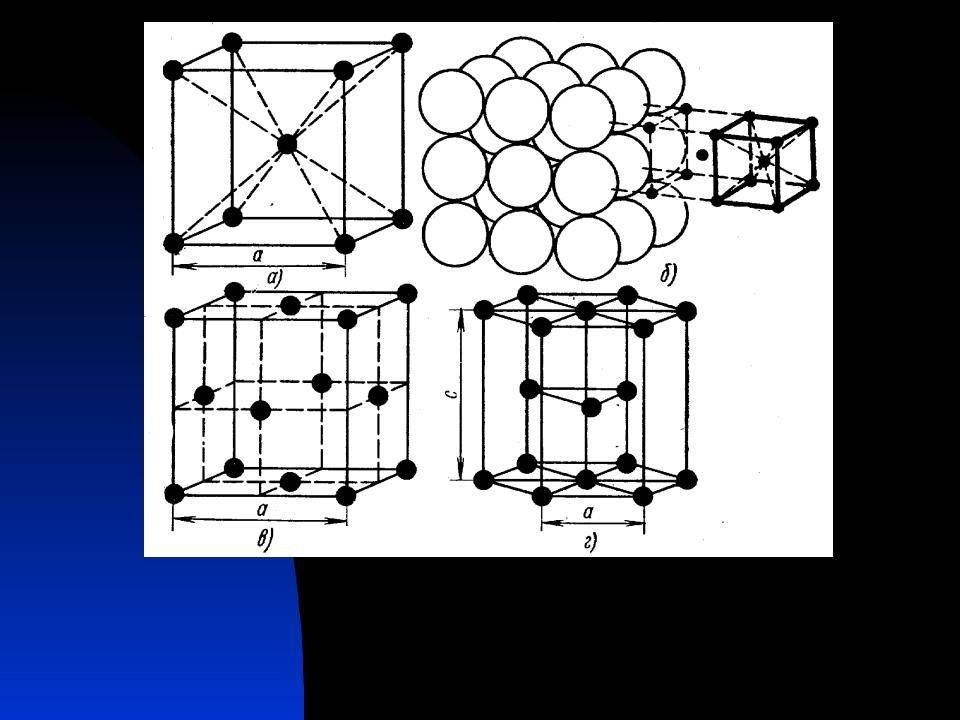
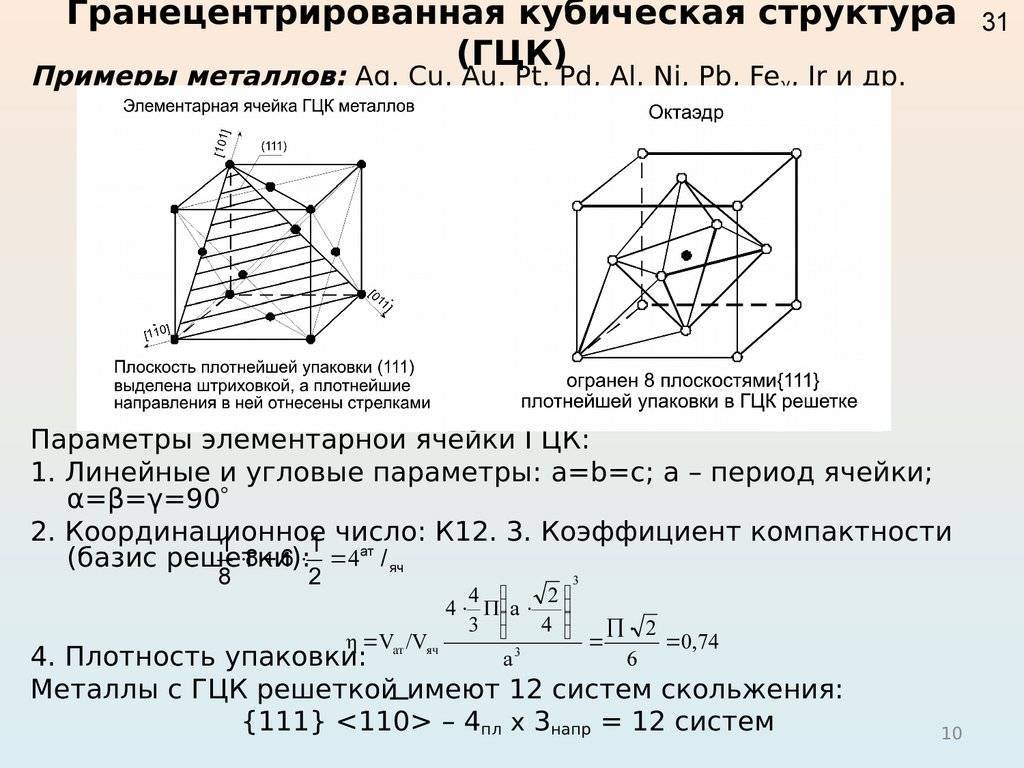
Гранецентрированная кубическая решетка
| Кубическая объемноцентрированная решетка. |
Гранецентрированная кубическая решетка отвечает кубической плотнейшей упаковке шаров.
| Схемы кристаллических решеток металлов. а — объемиоцентрированная кубическая, б — Гранецентрированная кубиче. |
Гранецентрированная кубическая решетка ( рис. 1, б) состоит из 14 атомов, расположенных по углам куба и в центре каждой из его граней. Такой вид решетки имеют, в частности, железо ( в интервале температур 910 — 1400), алюминий, медь и свинец.
| Схемы кристаллических решеток металлов. |
Гранецентрированная кубическая решетка ( рис. 1 6) состоит из 14 атомов, расположенных по углам — куба и в центре каждой из его граней. Такой вид решетки имеют, в частности, железо ( в интервале температур 910 — 1400), алюминий, медь и свинец.
Гранецентрированная кубическая решетка ( рис. 1, б) состоит из 14 атомов, расположенных по углам куба и в центре каждой из его граней. Такой вид решетки имеют, в частности, железо ( в интервале температур 910 — 1400), алюминий, медь и свинец.
Гранецентрированная кубическая решетка серебра имеет постоянную решетки а0 4078 нм. Найдите угол облучения, удовлетворяющий условиям отражения Брэгга для атомной плоскости, параллельной грани ( 100) монокристалла, если для облучения применяют монохроматическое рентгеновское излучение с длиной волны 0 1658 нм.
Гранецентрированную кубическую решетку имеют алюминий, кальций, кобальт, никель, платина, радий, свинец, серебро, стронций, торий, железо ( при 950), золото, иридий.
Как гранецентрированная кубическая решетка, так и плотная гексагональная упаковка построены посредством последовательного наложения двумерных гексагональных слоев атомов.
Для гранецентрированной кубической решетки обратная решетка — объемноцентрированный куб, и для этой структуры зона Бриллюэна представляет собой ячейку Вигнера — Зейтца.
Для гранецентрированной кубической решетки обратная решетка — объемноцентрированный куб, и для этой структуры зона Бриллюэна представляет собой ячейку Вигнера — Зейтца.
Рассмотрим гранецентрированную кубическую решетку; ее обратная решетка является объемноцентрированной.
Рассмотрим гранецентрированную кубическую решетку, в которой имеет место взаимодействие ближайших соседей. При учете взаимодействия только между ближайшими соседями суммирование по / в выражениях (1.36) и (1.39) легко выполняется.
В случае гранецентрированной кубической решетки ( квасцы) наиболее выгодной в энергетическом отношении оказалась конфигурация, при которой параллельно ориентированные диполи образуют цепи, причем ориентации соседних цепей противоположны. Однако для сфероида с отношением осей, большим чем 6: 1, свободная энергия становится меньшей для параллельной ориентации. Это обусловлено вкладом энергии размагничивания сфероида.
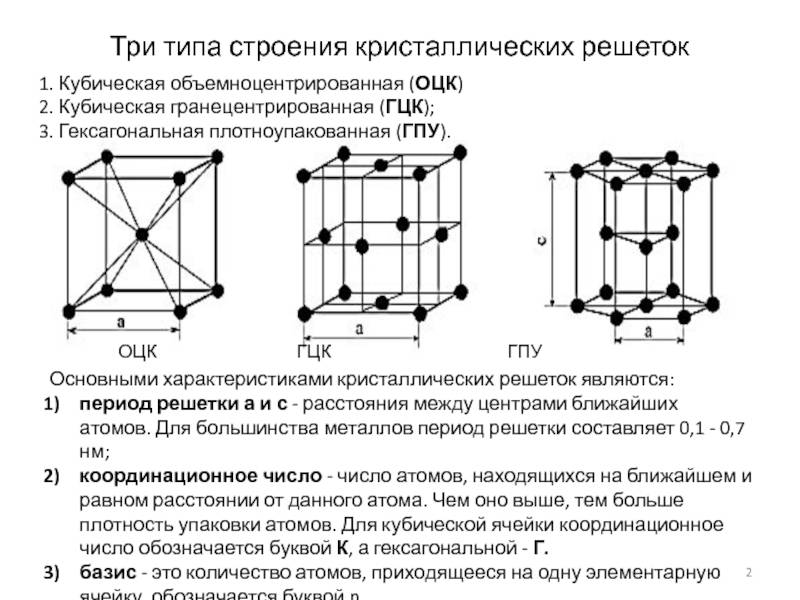
А) объемноцентрированная кубическая
б) гранецентрированная кубическая
в) гексагональная плотноупакованная
Некоторые металлы, в зависимости от температуры, могут иметь различный тип кристаллической решётки, т.е. могут существовать в различных кристаллических модификаций.
Полиморфизм (аллотропия) – когда металл имеет разную кристаллическую решётку в зависимости от условия образования. Переход одной решётки в другую называется полиморфное или аллотропическое состояние. Полиморфные превращения в металлах происходят при изменении температуры. Так, при температуре свыше 723°С железо переходит из α – модификации в γ – модификацию, при этом изменяются физико-механические свойства металла.
Чтобы отличить одну кристаллическую решётку железа Fe от другой ставят значок α или γ
В монокристаллах свойства металла по различным направлениям различны – это явление носит название анизотропией.
В реальных поликристаллических металлах свойства по любому направлению одинаково – это явление называется изотропией.
Металлы обладают целым рядом общих свойств:
Высокая электо- и теплопроводимость
Характерный металлический блеск
Положительный коэффициент электросопротивления
Способность к значительной пластической деформации
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным — железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Произвольный набор атомов
Тень обратной решетки интенсивности граненого углеродного пентакона, состоящего из 118 атомов, загорается красным при дифракции при пересечении сферы Эвальда.
Один путь к обратной решетке произвольного набора атомов происходит от идеи рассеянных волн в пределах Фраунгофера (дальнего расстояния или задней фокальной плоскости линзы) как суммы амплитуд в стиле Гюйгенса от всех точек рассеяния (в этот случай от каждого отдельного атома). Эта сумма обозначается комплексной амплитудой F в приведенном ниже уравнении, потому что это также преобразование Фурье (как функция пространственной частоты или обратного расстояния) эффективного потенциала рассеяния в прямом пространстве:
- Fг→знак равно∑jзнак равно1Nжjг→е2πяг→⋅р→j.{\ Displaystyle F = \ sum _ {j = 1} ^ {N} f_ {j} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {j}}.}
Здесь g = q / (2π) – вектор рассеяния q в единицах кристаллографа, N – число атомов, f j – атомный коэффициент рассеяния для атома j и вектор рассеяния g , а r j – положение вектора атом j
Обратите внимание, что фаза Фурье зависит от выбора начала координат.. Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}. Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где (часkл){\ displaystyle (hkl)}
- Fчасkлзнак равно∑jзнак равно1мжjгчасkле2πя(частыj+kvj+лшj){\ displaystyle F_ {hkl} = \ sum _ {j = 1} ^ {m} f_ {j} \ left e ^ {2 \ pi i \ left (hu_ {j} + kv_ {j} + lw_ {j} \ right)}}
когда j = 1, m атомов внутри элементарной ячейки, дробные индексы решетки которых равны соответственно {u j , v j , w j }. Конечно, чтобы учесть эффекты, связанные с конечным размером кристалла, вместо этого следует использовать свертку формы для каждой точки или приведенное выше уравнение для конечной решетки.
Независимо от того, является ли массив атомов конечным или бесконечным, можно также представить себе “обратную решетку интенсивности” I [ g ], которая связана с решеткой амплитуд F через обычное соотношение I = F * F, где F * – комплексное сопряжение F Поскольку преобразование Фурье обратимо, конечно, этот акт преобразования в интенсивность отбрасывает «всю информацию, кроме 2-го момента» (то есть фазы). Таким образом, для случая произвольного набора атомов обратная решетка интенсивности имеет вид:
- яг→знак равно∑jзнак равно1N∑kзнак равно1Nжjг→жkг→е2πяг→⋅р→jk.{\ displaystyle I = \ sum _ {j = 1} ^ {N} \ sum _ {k = 1} ^ {N} f_ {j} \ left f_ {k} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {jk}} .}
Здесь r jk – векторное расстояние между атомом j и атомом k. Это также можно использовать для прогнозирования влияния формы нанокристаллита и тонких изменений ориентации луча на обнаруженные дифракционные пики, даже если в некоторых направлениях толщина кластера составляет всего один атом. С другой стороны, расчеты рассеяния с использованием обратной решетки в основном учитывают падающую плоскую волну. Таким образом, после первого взгляда на эффекты обратной решетки (кинематического рассеяния), уширение луча и эффекты многократного рассеяния (т.е. динамические ) также могут быть важны для рассмотрения.




![Кубическая кристаллическая системасодержание а также решетки браве [ править ]](https://snabkz.ru/wp-content/uploads/b/4/2/b42dbdd73294a25f50de3627fc1ed3d7.jpeg)