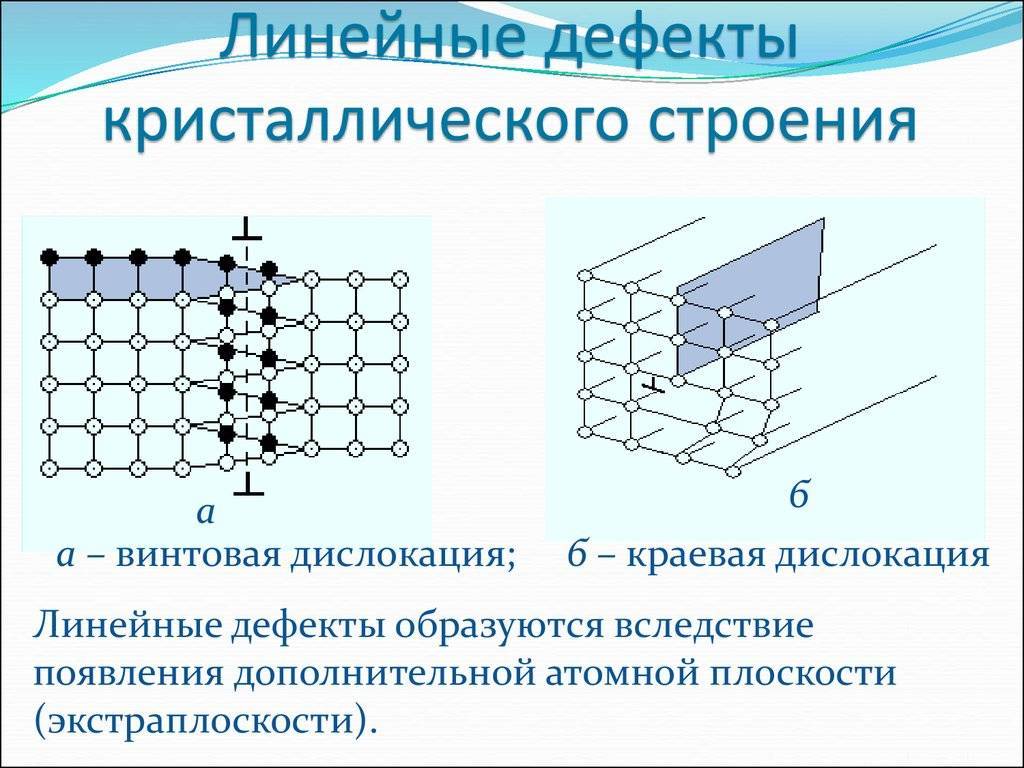
Особенности строения кристаллической решетки металлов металлический блеск
Найдите по таблице два металла с объемно-центрированной и гранецентрированной упаковкой с близкими температурами плавления (максимальное отличие 20 градусов). Посчитайте отношение их коэффициентов линейного расширения. Значение запишите с точностью до второго знака после запятой.
Прочитайте текст и выполните задания 16—18.
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет кристаллическое строение металлов. К специфическим свойствам рассматриваемых веществ относят следующие:
1. Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
2. Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
3. Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
Связь между коэффициентами линейного расширения,
температурами плавления металлов и симметрией
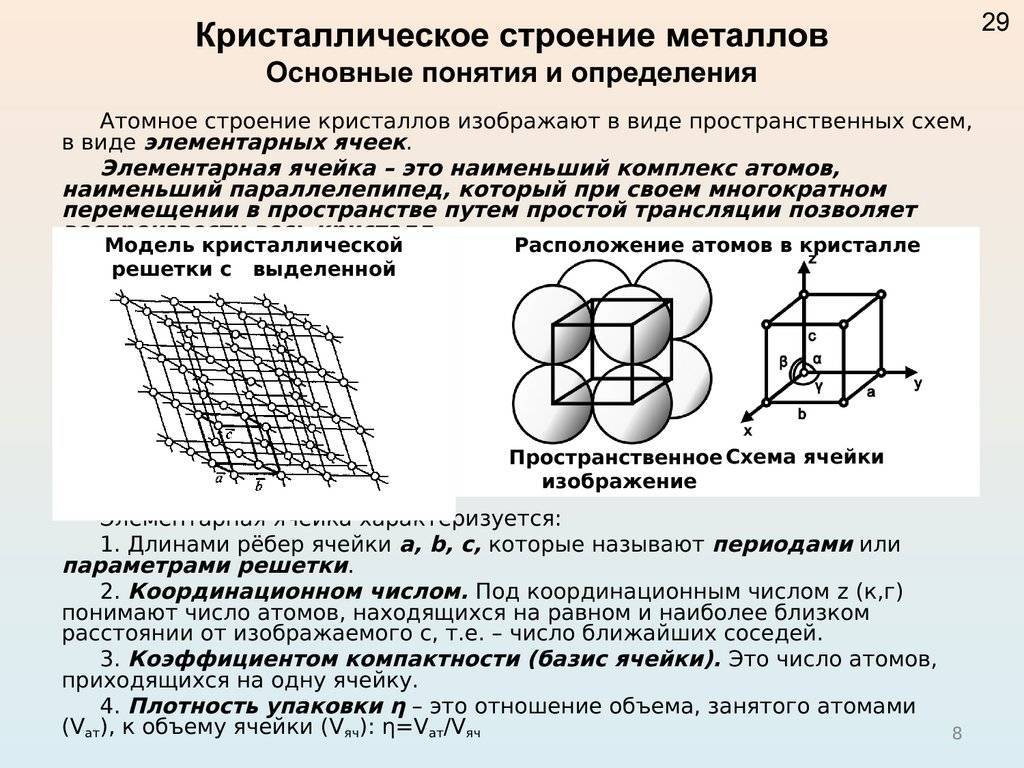
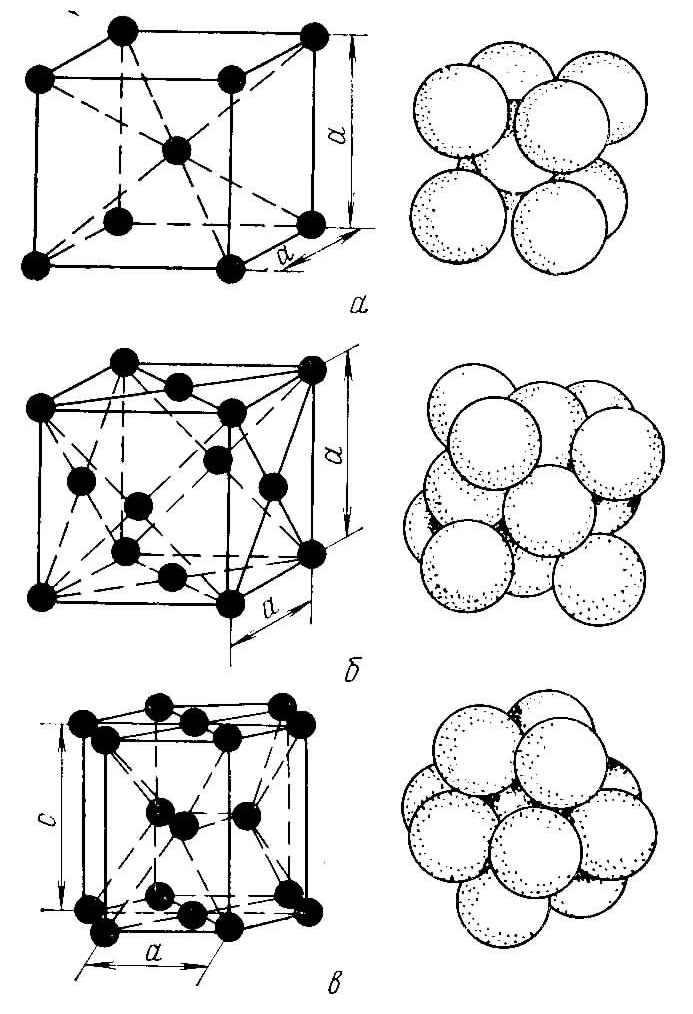
Кристалл — это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится изображение в виде правильного геометрического тела какой-либо формы. Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки.
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства. Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
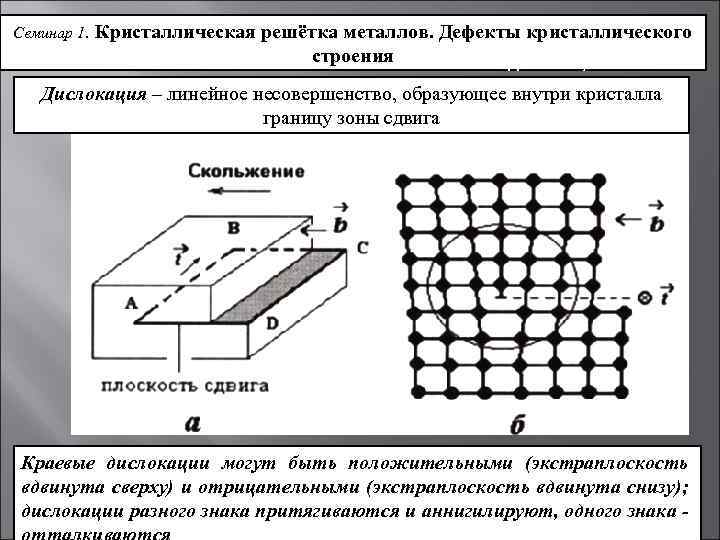
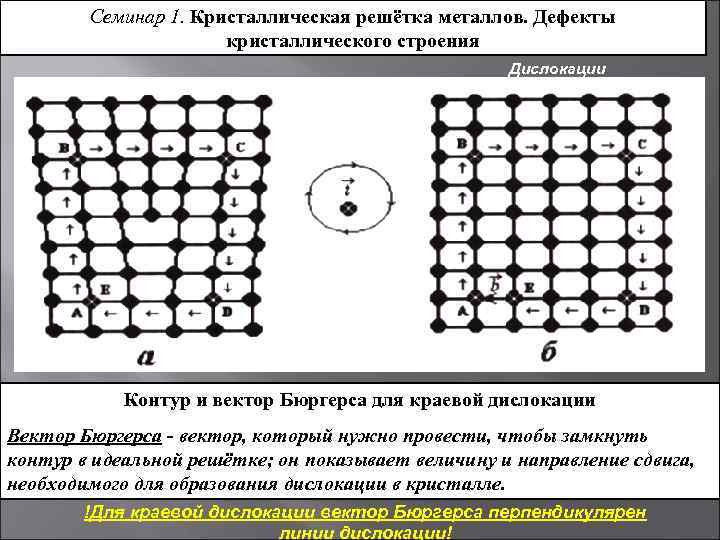
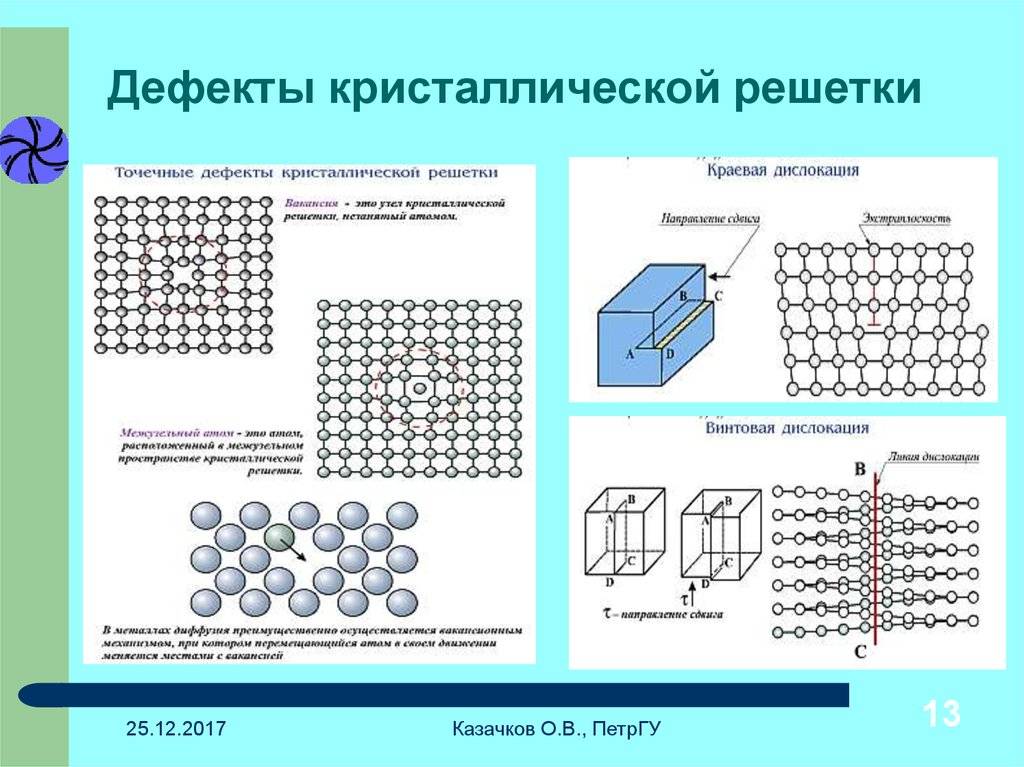
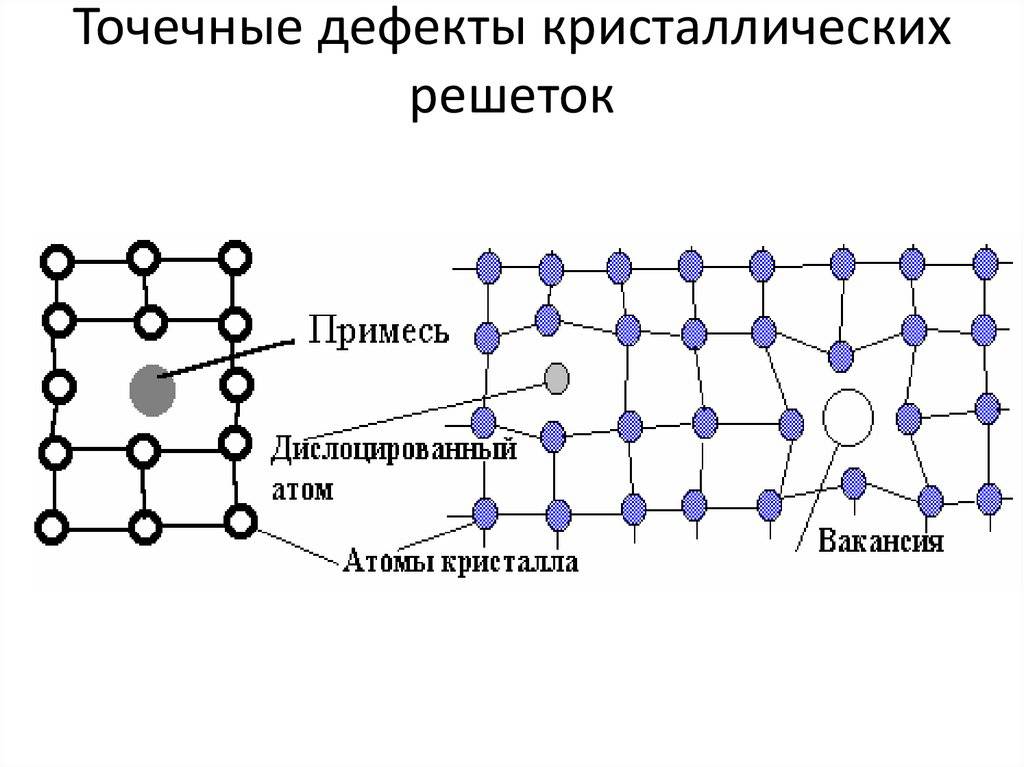
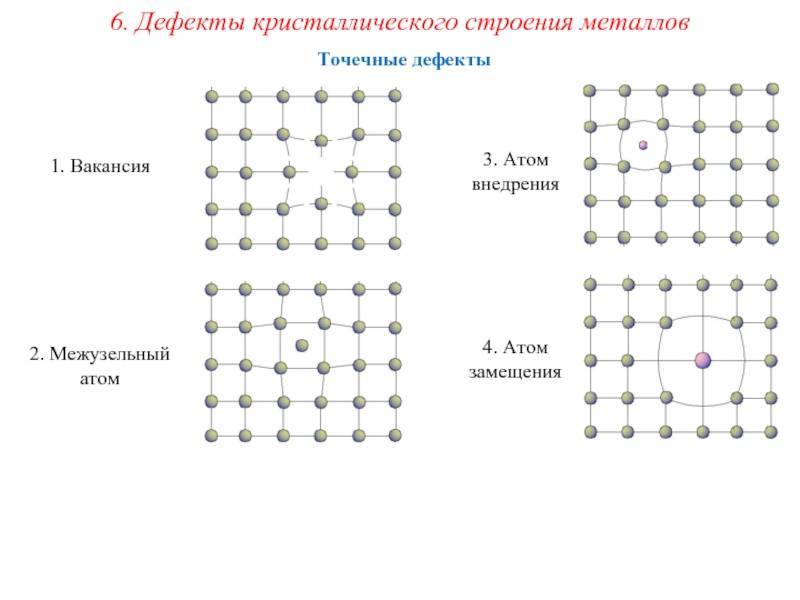
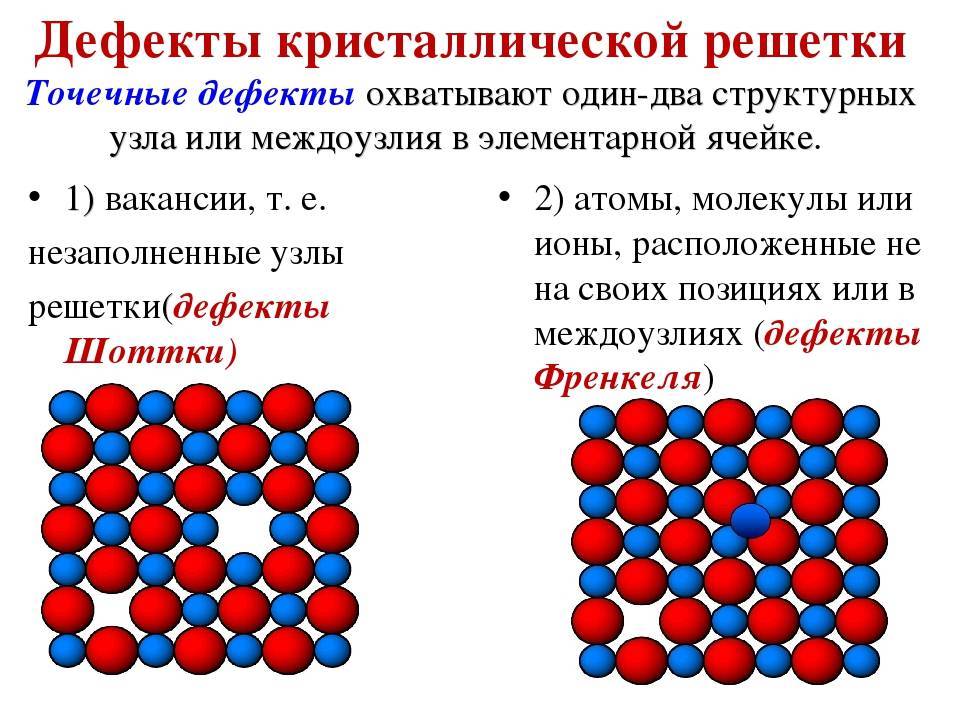
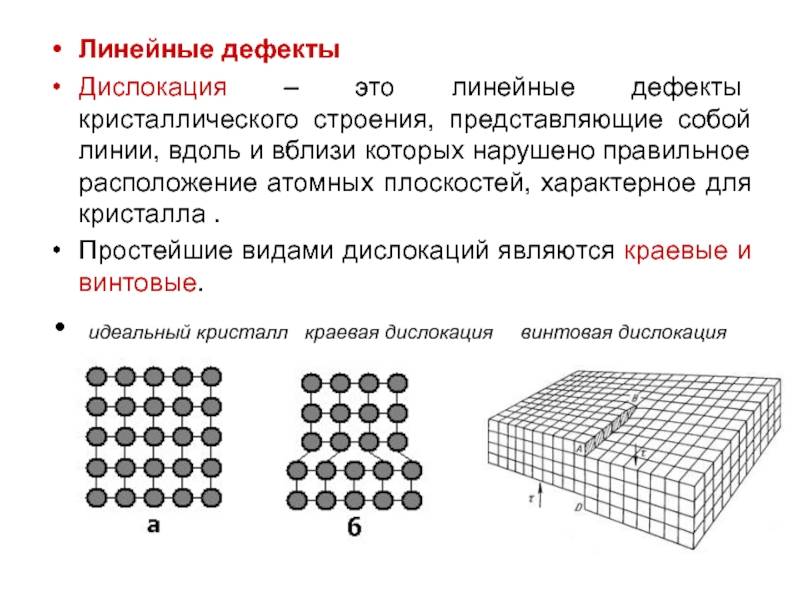
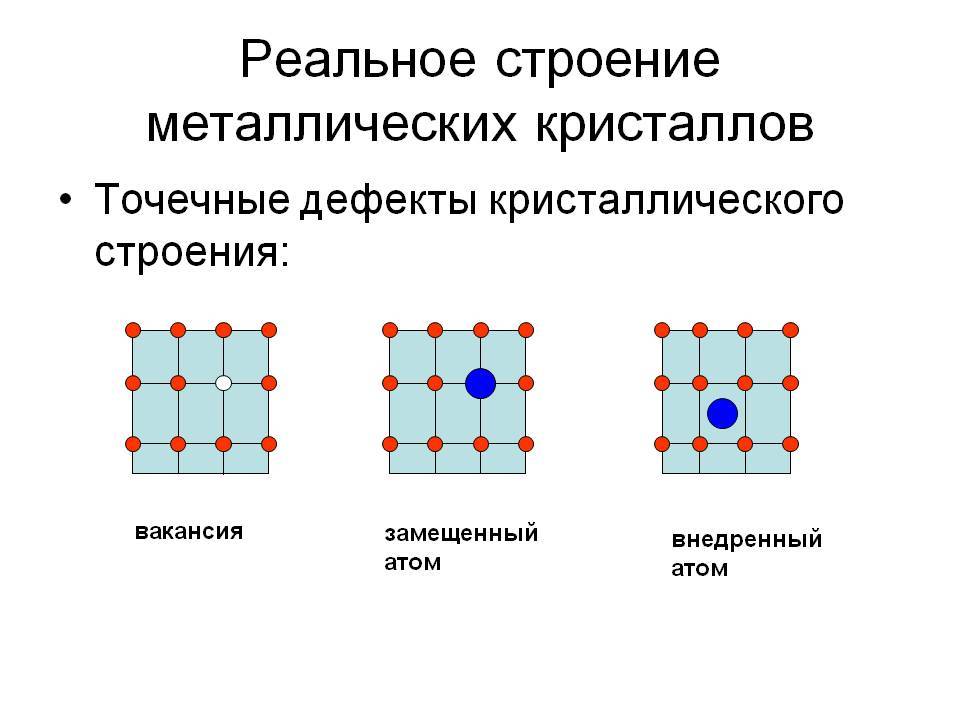
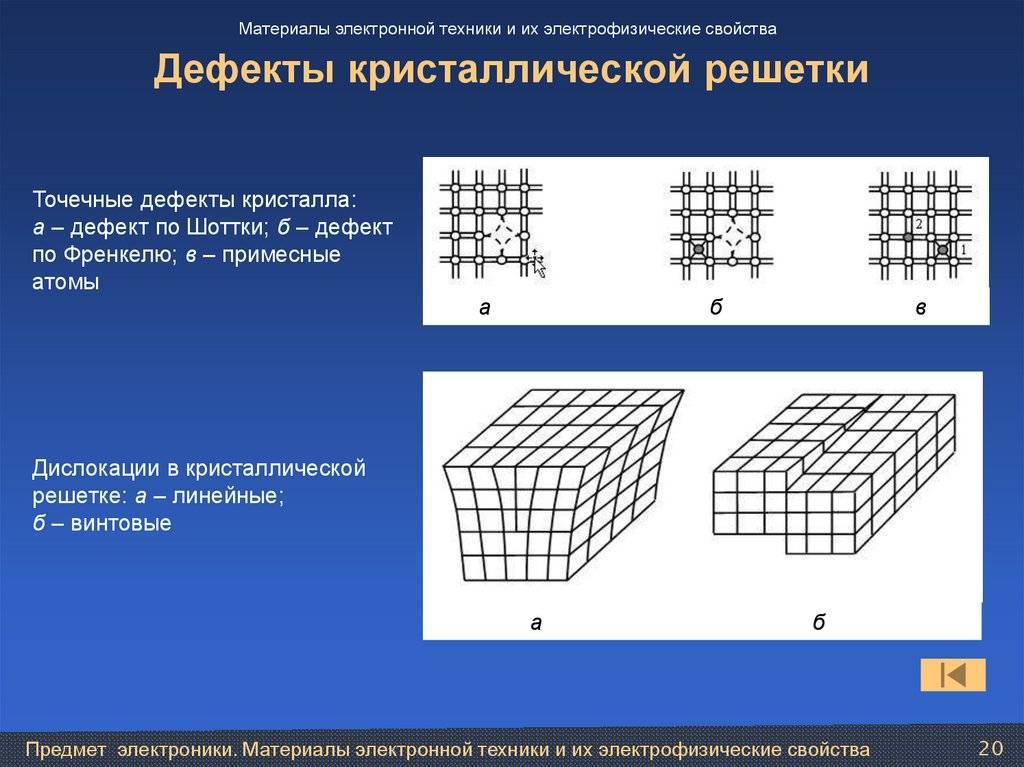
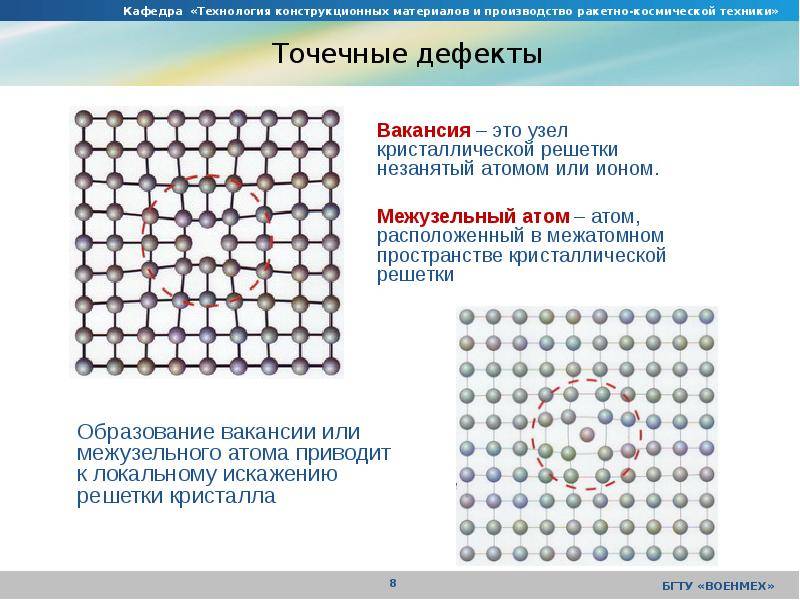
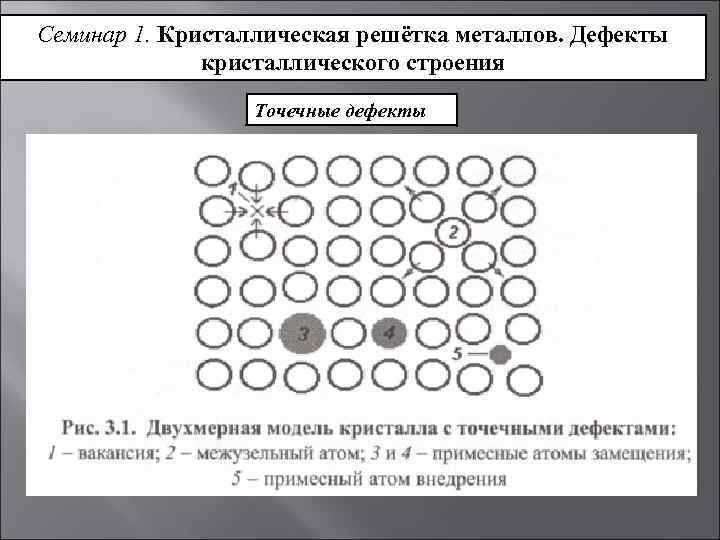
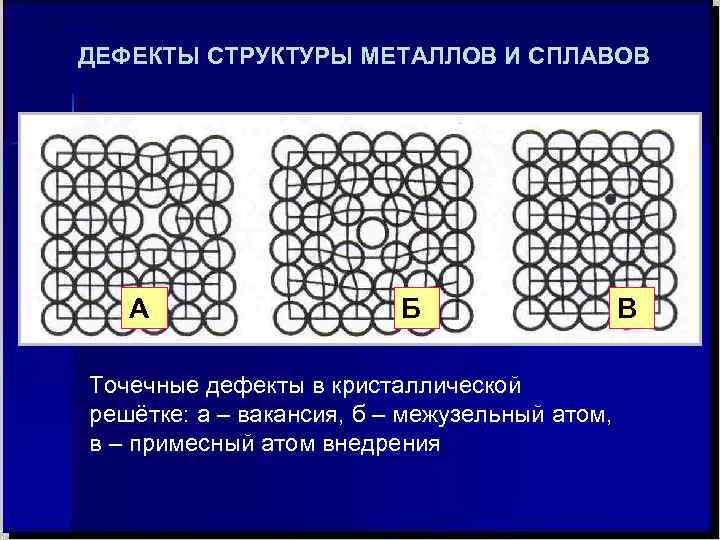
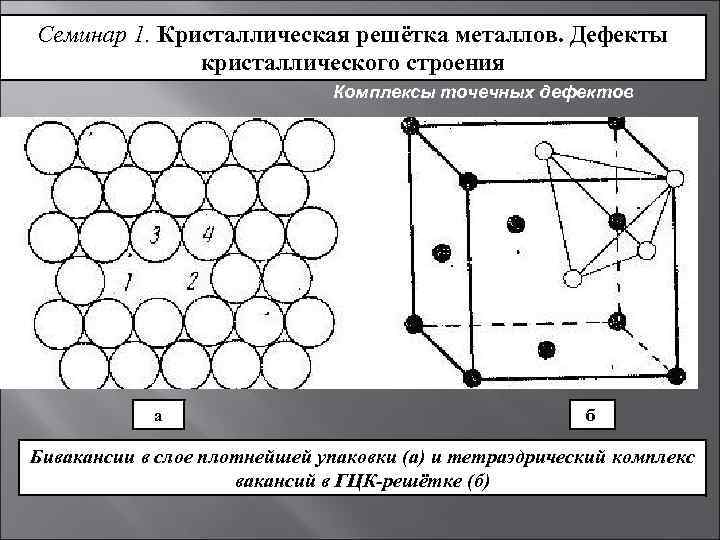
Точечные дефекты (нульмерные)
Точечные дефекты в кристаллах представляют собой искажения решётки с нулевой размерностью, т.е. ни в какой размерности они не обладают структурой решётки.

Типичные точечные несовершенства подразделяются на три группы:
примесные атомы в чистом металле;
вакансии;
межузельные атомы.
Вакансии получают путём нагревания в концентрациях, достаточно высоких для количественных исследований. Для получения аналогичных концентраций межузельных атомов точечные искажения можно получить, выполняя внешнюю работу с кристаллом. Такая работа выполняется в атомном масштабе за счет облучения энергоёмкими частицами. Столкновения между посторонними атомами и атомами решётки вызывают смещения последних от мест замещения к местам внедрения. Таким образом, вакансии и междоузлия производятся в равных количествах. Поскольку одна вакансия и одно междоузлие вместе образуют дефект Френкеля, облучение, по сути, является процессом образования такого дефекта. Это невыгодно по сравнению с экспериментальным исследованием межузельных свойств, поскольку радиационно-индуцированные изменения свойств кристаллов всегда включают роль вакансий.
При пластической деформации также образуются вакансии и межузельные частицы. Хотя деформация обходится намного дешевле, чем облучение частицами, метод не стал общепринятой процедурой для создания точечных дефектов, поскольку не позволяет производить контролируемое образование искажений независимо от сложных сетей дислокаций.
Аномально высокие концентрации точечных несовершенств встречаются в некоторых нестехиометрических интерметаллических соединениях. Здесь вакансии и внедрения уже играют роль дополнительных легирующих элементов и имеют в этом смысле термодинамическое значение.
Другие методы получения точечных дефектов – быстрая закалка, испарение на холодных подложках или лазерный отжиг – зависят от термически активированного производства.
В чистых металлах и в большинстве сплавов вакансии обеспечивают термически активированный перенос атомов и, следовательно, свойства вакансий напрямую влияют на перенос атомов. Свойства вакансии дают информацию о межатомных силах с помощью особых возмущений, которые зависят от вакантного узла решётки.
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
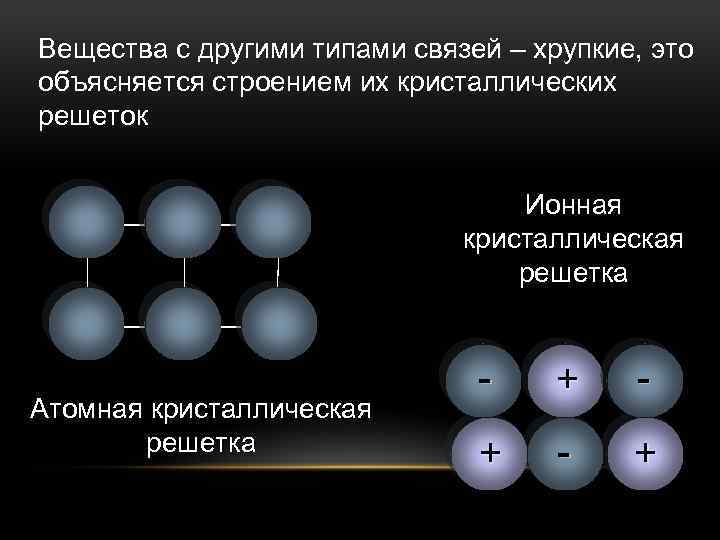
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.

Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.

Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.

Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
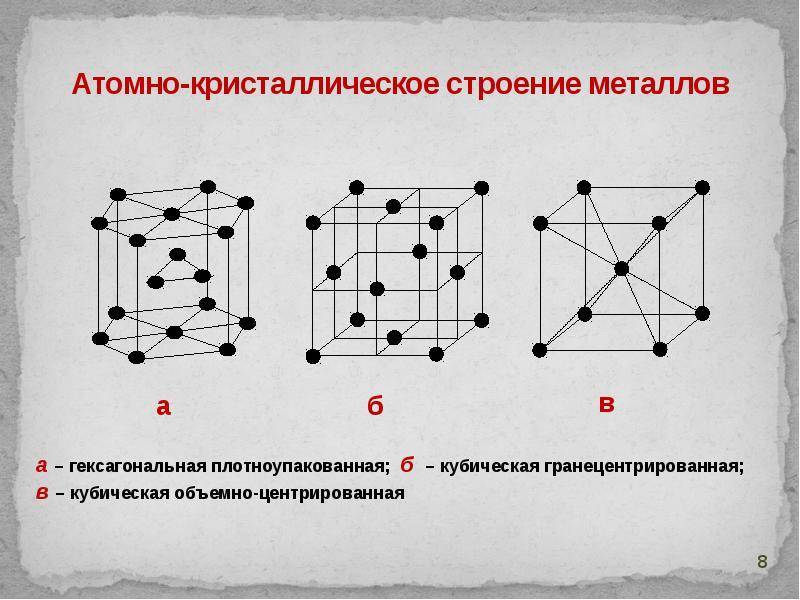
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Атом и молекула железа. Формула железа. Строение атома железа:
Железо (лат. Ferrum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Fe и атомным номером 26. Расположен в 8-й группе (по старой классификации – побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Железо – металл. Относится к группе переходных металлов. Относится к чёрным металлам.
Как простое вещество железо при нормальных условиях представляет собой ковкий, вязкий металл серебристо-белого цвета с сероватым оттенком с высокой химической реакционной способностью. Собственно железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. На практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая (легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.).
Молекула железа одноатомна.
Химическая формула железа Fe.
Электронная конфигурация атома железа 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Потенциал ионизации (первый электрон) атома железа равен 762,47 кДж/моль (7,9024681(12) эВ).
Строение атома железа. Атом железа состоит из положительно заряженного ядра (+26), вокруг которого по четырем оболочкам движутся 26 электронов. При этом 24 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку железо расположено в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома железа на 3d-орбитали находится два спаренных и четыре неспаренных электрона. На внешнем энергетическом уровне атома железа – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома железа состоит из 26 протонов и 30 нейтронов.
Радиус атома железа (вычисленный) составляет 156 пм.
Атомная масса атома железа составляет 55,845(2) а. е. м.
Железо – один из самых распространённых в земной коре металлов – занимает четвертое место. Содержание в земной коре железа составляет 6,3 % (по массе). По этому показателю железо уступает только кислороду, кремнию и алюминию.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 oC.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 oC). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким — литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Реальный кристалл металла
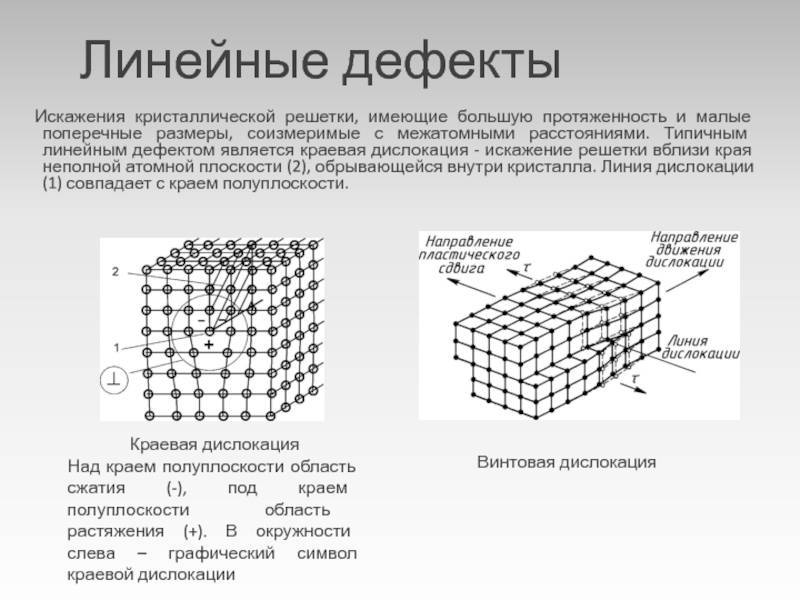
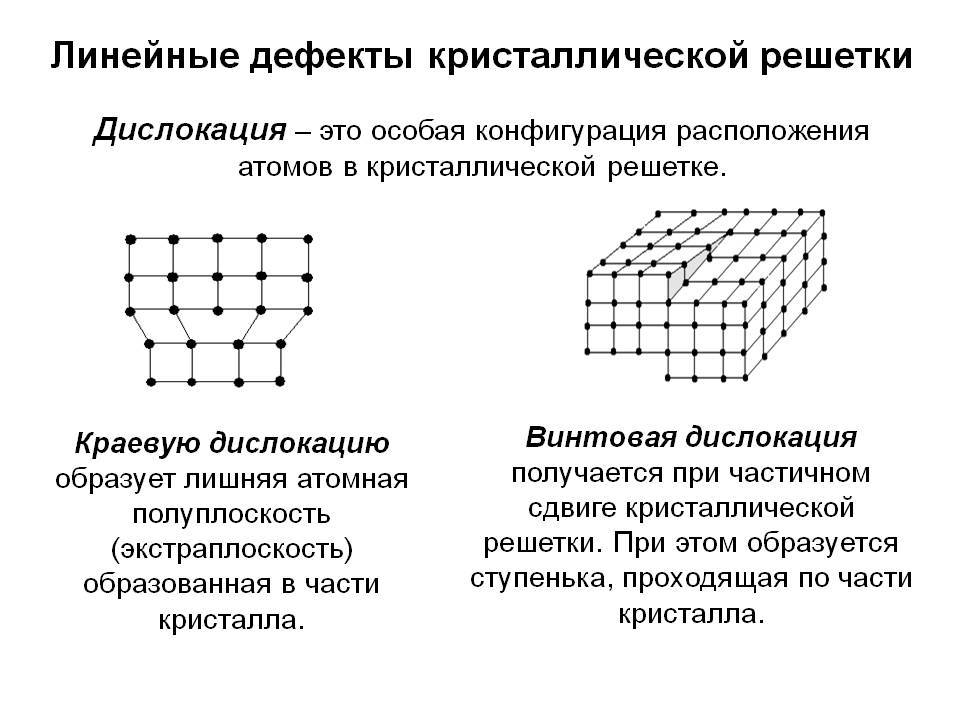
Какой бы химический металлический элемент не рассматривался, в действительности он представляет собой твердое вещество, в котором маленькие монокристаллы (зерна) соединены друг с другом в различных ориентациях. Такая структура образует поликристалл. В нем, помимо границ зерен, присутствуют дефекты всех четырех типов, включая примеси таких неметаллов, как кислород, азот и водород. Последний из-за своих размеров легко проникает в любую кристаллическую решетку, образует с ее ионами твердые фазы, которые приводят к охрупчиванию металла, что является одной из актуальных проблем металловедения.
Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение – это науки, которые занимаются изучением особенностей строения таких структур.
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Читать также: Пресс гранулятор для опилок
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платина
Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий
Сканидий
Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
https://youtube.com/watch?v=01JxRXVDSvc