Краткое описание
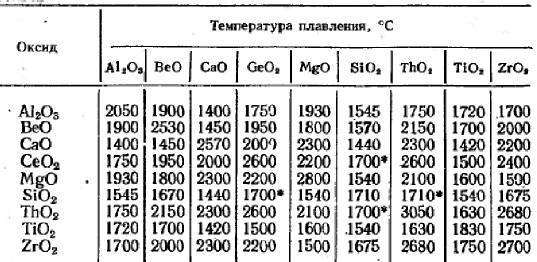
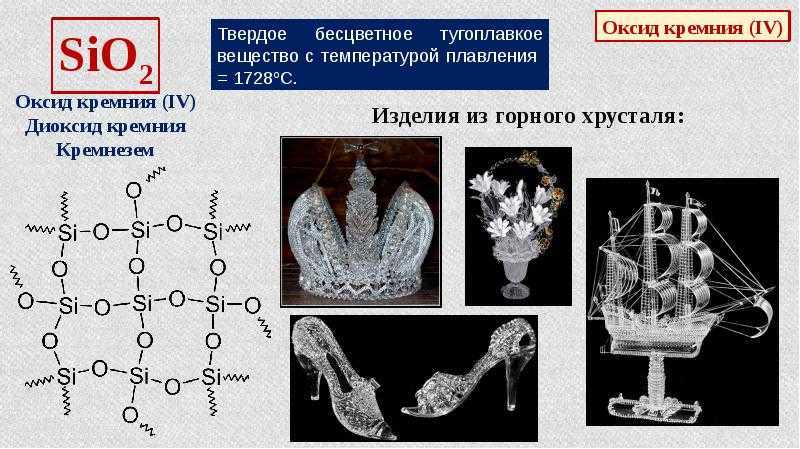
Оксид кремния (IV) SiO2 представляет собой твёрдое, тугоплавкое кристаллическое вещество, которое не растворяется в воде и не вступает с ней в реакцию. Химический компонент проявляет окислительные свойства. При температуре от +1000°C SiO2 взаимодействует с активными металлами. В этом случае образуется кремний:
- SiO2 + 2Mg = Si + 2MgO.
- 3SiO2 + 4Al = 3Si + 2Al2O3.
При избытке кремния происходит восстановление силицидов. Эта химическая реакция имеет следующую формулу: SiO2 + 4Mg = Mg2Si + 2MgO. Силициум взаимодействует с водородом, а при использовании углерода образуется карборунд: SiO2 + 3C = SiC + 2CO.
Если попробовать сплавить оксид кремния со щелочами, то в итоге можно будет получить силикаты:
- SiO2 + 2NaOH = Na2SiOO3 + H2O.
- SiO2 + CaO = CaSiO3.
- SiO2 + K2CO3 = K2SiO3 + CO2.
- SiO2 + H2O ≠.
При нормальном давлении и температуре воздуха можно выделить три кристаллические модификации SiO2: тридимит, кварц и кристобалит. В каждом случае известны высокотемпературные и низкотемпературные формы. В их основе лежат тетраэдры SiO4, которые соединены четырьмя атомами кислорода в трёхмерной решётке.
Свойства монооксида
На уроках химии можно узнать, что формула оксида кремния выглядит следующим образом — SiO2. Внешне это вещество имеет вязкую консистенцию, больше напоминает смолу. Без какого-либо воздействия оксид кремния отлично сохраняет своё конденсированное состояние, не подвержен окислению. SiO2 не влияет на образование солей, а также не пропускает ток. Получить монооксид кремния можно двумя доступными методами:
- Нагреть кремний до отметки +400°C и выше при недостаточном объёме кислорода. Формула выглядит следующим образом: 2Si + O2 → 2SiO.
- Использование специального метода Чохральского (выращивание монокристаллов путём вытягивания их вверх от свободной поверхности большого объёма расплава) при восстановлении диоксида в условиях высоких температур. Формула: 2SiO2 + Si → 2SiO.
В твёрдом состоянии монооксид представляет собой порошок коричневого цвета. Это химическое вещество обладает высокой прочностью и инертностью при условии взаимодействия с кислотами. Добиться полного растворения монооксида можно только в плавиковой кислоте. Среди основных химических свойств SiO2 можно выделить:
- Монооксид может разлагаться только под воздействием высоких температур. Отобразить эту реакцию можно с помощью следующей формулы: 2SiO → 2Si + О2.
- При нагревании монооксид взаимодействует с СО2. Формула: SiO + CO2 → SiO2 + CO.
- Монооксид кремния вступает в реакцию с парами Н2О, но только при условии нагревания до +500°C. Этот процесс хорошо виден в формуле: SiO + H2O → SiO2 + H2.
- Жидкий хлорид кремния можно получить в том случае, если дополнительно задействовать хлор и нагреть смесь до +800°C. Наглядно эта реакция выглядит так: 2SiO + 4Cl2 → 2SiCl4 + O2.
Характеристика диоксида
Оксид кремния (SiO2) представляет собой кристаллическое тугоплавкое вещество, которое не растворяется в воде. Этот химический компонент не проводит электрический ток. На уроках химии в 8 классе учащимся объясняют, что диоксид входит в состав следующих горных пород:
- Песка.
- Горного хрусталя.
- Яшмы.
- Кварца.
- Агата.
- Аметиста.
Литосфера на 87% состоит из диоксида. Это химическое вещество имеет немолекулярное строение. Атомы кислорода и кремния связаны ковалентным способом. Благодаря этому сформировалась кристаллическая решётка. Диоксид можно получить в лабораторных условиях. Для этого кремний вместе с кислородом нагревают до отметки +500°C: Si + O2 → SiO2.
После воздействия кислот на растворимые силикаты образуется диоксид. В итоге формируется кремниевая кислота, которая распадается на диоксид и воду. Химическая реакция выглядит следующим образом:
- Na2 SiO3 + 2CH3COOH → 2CH3COONa + H2SiO3↓.
- H 2SiO3 → H2O + SiO2.
В нормальных условиях диоксид вступает в реакцию только с плавиковой кислотой. А вот с основными оксидами и щелочами может взаимодействовать только при воздействии высоких температур. Диоксид не реагирует на Н2О. Сегодня это химическое вещество используется для серийного производства силикагеля, стекла и бетона.
Основные характеристики
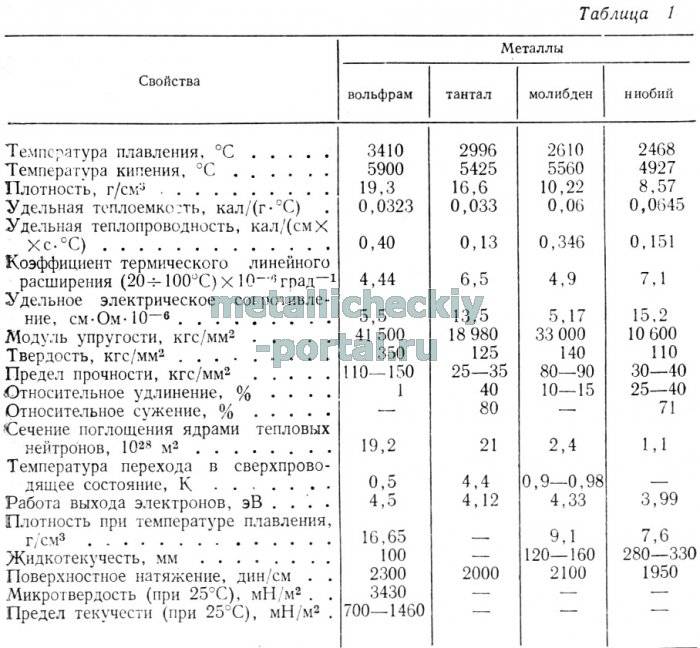
Как самый тугоплавкий металл, вольфрам имеет специфические свойства:
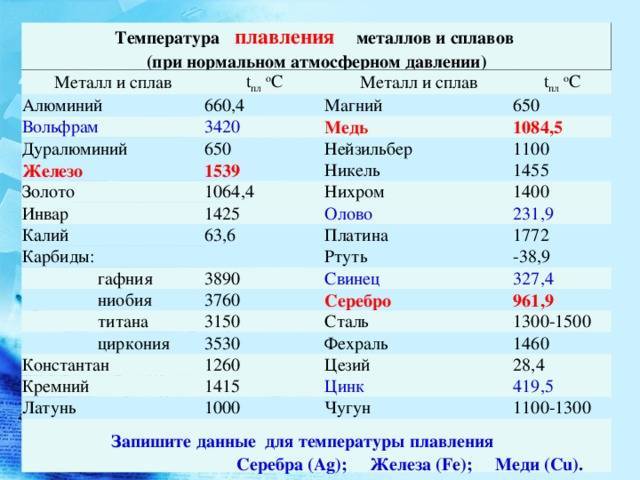
- Температура плавления вольфрама — примерно соответствует температуре солнечной короны — 3422 °С.
- Вместе с этим, плотность чистого вольфрама ставит его в один ряд с наиболее плотными металлами. Его плотность практически равна плотности золота — 19,25 г/см3.
- Теплопроводность вольфрама зависит от температуры и составляет от 0,31 кал/см·сек·°С при 20°С до 0,26 кал/см·сек·°С при 1300°С.
- Теплоемкость также близка к золоту и составляет 0.15·103 Дж/(кг·К).
Металл имеет кубическую объемноцентрированную кристаллическую решетку. Несмотря на высокую твердость, вольфрам в нагретом состоянии очень пластичен и ковок, что позволяет изготавливать из него тонкую проволоку, имеющую широкое применение.

Вольфрамовая проволока
Имеет серебристо-серый цвет, который не меняется на открытом воздухе, поскольку вольфраму присуща высокая химическая стойкость, а с кислородом он реагирует только при температуре выше красного каления.
Химические свойства элемента, как правило, начинают проявляться при нагреве выше нескольких сотен градусов. В обычных условиях он не взаимодействует с большинством известных кислот, кроме смеси плавиковой и азотной кислот. В присутствии определенных окислителей может реагировать с расплавами щелочей. При этом для начала реакции требуется нагрев до температуры 400 — 500 °С, а далее реакция идет бурно, с выделением тепла.
Некоторые соединения, особенно карбид вольфрама, обладают очень высокой твердостью и находят применение в металлургическом производстве для обработки твердых сплавов.
Приведенные характеристики вольфрама определяют специфику областей применения металла, как в чистом виде, так и в составе различных сплавов и химических соединений. Вольфрам входит в состав многих жаростойких сплавов в качестве легирующей добавки для повышения твердости, температуры плавления и коррозионной стойкости. Близость плотности и теплоемкости вольфрама и золота теоретически может служить для подделки золотых слитков, однако это легко можно выявить при измерении электрического сопротивления и при переплавке золотого слитка.
Химические свойства
Проявляет валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в оксид вольфрама (VI). Вольфрам в ряду напряжений стоит сразу после водорода, и в соляной, разбавленной серной и плавиковой кислотах почти нерастворим. В азотной кислоте и царской водке окисляется с поверхности. Растворяется в перекиси водорода.
Легко растворяется в смеси азотной и плавиковой кислот:
Реагирует с расплавленными щелочами в присутствии окислителей:
Поначалу данные реакции идут медленно, однако при достижении 400 °C (500 °C для реакции с участием кислорода) вольфрам начинает саморазогреваться, и реакция протекает достаточно бурно, с образованием большого количества тепла.
Растворяется в смеси азотной и плавиковой кислоты, образуя гексафторвольфрамовую кислоту H2. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Системы пневмотранспорта. База знаний
 Каталог шиберных задвижек для систем пневмотраспорта сыпучих продуктов
Каталог шиберных задвижек для систем пневмотраспорта сыпучих продуктов
Каталог шиберных задвижек на сайте PT-Systems включает в себя различные модели запорной арматуры для пневмотранспортных систем и трубопроводов. Здесь можно найти запоры с электрическим или механич…

В московской компании PT-Systems («ЭкоУниверсал») можно купить шиберную задвижку с любыми техническими характеристиками. Оформление заказа происходит в дистанционном режиме на сайте или по телефону…
 Как и из чего производят встраиваемые переключатели потоков и другие приборы для пневмотранспорта в каталоге PT-Systems
Как и из чего производят встраиваемые переключатели потоков и другие приборы для пневмотранспорта в каталоге PT-Systems
В компании PT-Systems можно купить весовой дозатор сыпучих материалов, перекидные клапаны, шлюзовый затвор, распределители потоков и иное специализированное оборудование для пневмотранспортных сист…
 Весовые дозаторы для упаковки сыпучих продуктов и разгрузочные станции для систем пневмотранспорта
Весовые дозаторы для упаковки сыпучих продуктов и разгрузочные станции для систем пневмотранспорта
Объемный или весовой дозатор для упаковки сыпучих продуктов – это многофункциональный аппарат, который способен одновременно выполнять сразу же несколько действий: дозировать, укомплектовывать, упа…
 Особенности изготовления шлюзовых затворов и другой пневмотранспортной арматуры
Особенности изготовления шлюзовых затворов и другой пневмотранспортной арматуры
Производство шлюзовых затворов и иной специализированной трубопроводной арматуры осуществляется с планомерным соблюдением требований национальных ГОСТов и технических регламентов.
…
 Дозаторы, питатели и переключатели потоков в системах пневмотранспорта
Дозаторы, питатели и переключатели потоков в системах пневмотранспорта
В компании PT-Systems можно купить любое оборудование для пневмотранспортных установок: шлюзовые затворы, весовые дозаторы сыпучих продуктов, переключатели потока рабочей среды и т.д.
…
 Как выбрать шнековый дозатор для систем пневмотранспорта сыпучих продуктов
Как выбрать шнековый дозатор для систем пневмотранспорта сыпучих продуктов
Шнековые дозаторы сыпучих продуктов – это специальные агрегаты по выдаче порций конкретной величины в заданном промежутке времени.
Процедура дозирования может производиться по в…
 Правильный выбор шиберных задвижек для сыпучих продуктов систем пневмотранспорта
Правильный выбор шиберных задвижек для сыпучих продуктов систем пневмотранспорта
Шиберные затворы из нержавеющей стали – это типовая трубопроводная арматура. Изделия используются для стандартного перекрытия рабочего потока среды во всевозможных промышленных системах.
…
 Наноструктурированное CVD-покрытие из карбида вольфрама защитит от износа и коррозии
Наноструктурированное CVD-покрытие из карбида вольфрама защитит от износа и коррозии
Наноструктурированное CVD-покрытие из карбида вольфрама ЗАЩИТИТ ОТ ИЗНОСА И КОРРОЗИИ
This paper was presented at Corrosion 2010 held on March 14-18, 2010 in San Antonio, Texas….

В интернет магазине PT-Systems можно купить дозатор сыпучих продуктов для любой системы пневмотранспорта. Фирма много лет работает на рынке Москвы и Московской обл…
Еще
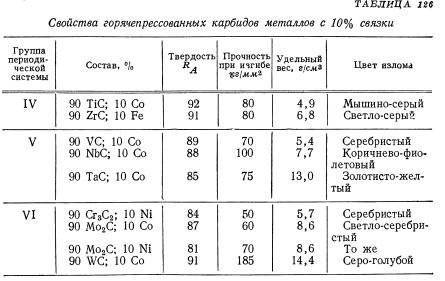
Карбиды вольфрама
Твердые сплавы рассмотрим более подробно. Тугоплавкий металл может образовывать разные карбиды: полукарбид и монокарбид. Они отличаются способностью растворять в себе тугоплавкие металлы и взаимодействием с разными кислотами.
Вольфрам – металл имеющий разные карбиды
Также монокарбид уступает поликарбиду в устойчивости и твердости. А к преимуществам монокарбида можно отнести способность к образованию кристаллов в расплавленном вольфраме, что дает возможность использовать его в минералокерамических изделиях. Полукарбид обладает большей устойчивостью к температурам, легкостью внедрения в твердые растворы монокарбида с другими металлами (феррумом, кобальтом), повышенной износоустойчивостью.
Физико-химические характеристики
Чистый вольфрам – в числе первых по плотности, твердости, первый по температуре плавления и кипения среди металлов. Эти физические свойства дополняет химическая стойкость даже при запредельных температурах.
| Свойства атома | |
|---|---|
| Название, символ, номер | Вольфра́м / Wolframium (W), 74 |
| Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) |
| Электронная конфигурация | 4f14 5d4 6s2 |
| Радиус атома | 137 пм |
| Химические свойства | |
| Ковалентный радиус | 170 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,3 (шкала Полинга) |
| Электродный потенциал | W ← W3+ 0,11 В W ← W6+ 0,68 В |
| Степени окисления | +2, +3, +4, +5, +6 |
| Энергия ионизации (первый электрон) | 769,7 (7,98) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 19,25 г/см³ |
| Температура плавления | 3695 K (3422 °C, 6192 °F) |
| Температура кипения | 5828 K (5555 °C, 10031 °F) |
| Уд. теплота плавления | 285,3 кДж/кг 52,31 кДж/моль |
| Уд. теплота испарения | 4482 кДж/кг 824 кДж/моль |
| Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| Молярный объём | 9,53 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,160 Å |
| Температура Дебая | 310 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 162,8 Вт/(м·К) |
| Номер CAS | 7440-33-7 |
При 1580°C легко куется, вытягивается до тонкой проволоки.
Данные преимущества создает структура вещества.
Тугоплавкий прочный металл, светло-серого цвета — вольфрам
На воздухе с относительной влажностью менее 60% сопротивление металла коррозии стопроцентное.
Получение карбидов
Первые два вида карбидов, которые мы рассмотрели, а именно ковалентные и солеобразные, получают чаще всего одним простым способом: реакцией оксида элемента и кокса при высокой температуре. При этом часть кокса, состоящего из углерода, соединяется с атомом элемента в составе оксида, и образует карбид. Другая часть «забирает» кислород и образует угарный газ. Такой способ очень энергозатратен, так как требует поддержания высокой температуры (порядка 1600-2500 градусов) в зоне реакции.
Для получения некоторых видов соединений используют альтернативные реакции. Например, разложение соединения, которое в конечном итоге даёт карбид. Формула реакции зависит от конкретного соединения, поэтому обсуждать её мы не будем.
Прежде чем завершить нашу статью, обсудим несколько интересных карбидов и поговорим о них подробнее.
Основные характеристики вольфрама
Для практического применения наиболее важны высокие показатели следующих характеристик:
электрическое сопротивление;
коэффициент линейного расширения;
температура плавления.
Чистый вольфрам обладает высокой пластичностью, не растворяется в специальном кислотном растворе без предварительного нагрева хотя бы до 5000С. Он легко вступает в реакцию с углеродом, следствием которой является образование карбида вольфрама известного высокой прочностью. Также металл известен своими оксидами, наиболее распространенный из них вольфрамовый ангидрид. Его главное преимущество над остальными, возможность восстановления порошка к состоянию компактного металла, с побочным образованием низших оксидов.

Режущие пластины фирмы Sandvik Coromant с применением карбида вольфрама
Среди основных характеристик, делающих применение вольфрама затруднительным называют следующие:
высокая плотность;
ломкость и склонность к окислению при низких температурах.
Кроме того, высокая температура кипения, а также точка испарения затрудняют добычу компактного материала.
СТРУКТУРА
Кристалл вольфрама имеет объемноцентрированную кубическую решетку. Кристаллы вольфрама на холоду отличаются малой пластичностью, поэтому в процессе прессования порошка они практически почти не изменяют своей основной формы и размеров и уплотнение порошка происходит главным образом путем относительного перемещения частиц.
В объемно-центрированной кубической ячейке вольфрама атомы располагаются по вершинам и в центре ячейки, т.е. на одну ячейку приходится два атома. ОЦК-структура не является плотнейшей упаковкой атомов. Коэффициент компактности равен 0,68. Пространственная группа вольфрама Im3m.
Химические свойства вольфрама:
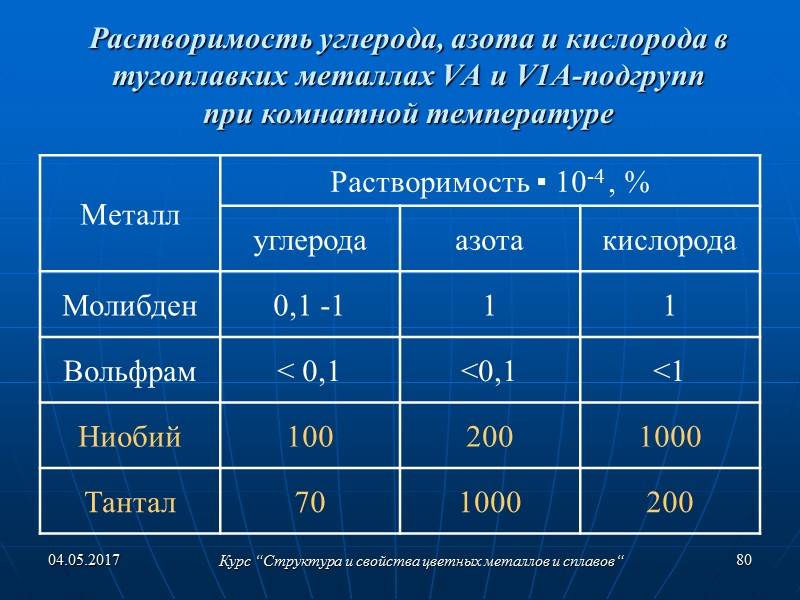
- в природе состоит из стабильных изотопов (5 штук), массовые числа которых находятся в пределах 180-186;
- отделение 74 электронов атома W происходит легко;
- обладает 6 валентностью, в соединениях может иметь 0, 2, 3, 4 и 5-валентным;
- орбита элемента включает 2 яруса, что позволяет образовать крепкую химическую связь.
Наука относит вольфрам к химически активным элементам. Он может вступать в различные реакции и образовывать как простые, так и сложные соединения. В сплавах W чаще всего остается химически связанным. При этом с окислителями (например, с кислородом) он реагирует быстрее, чем другие металлы рода «тяжеловесов».
В случае нагревания элемента он еще быстрее вступает в реакцию с кислородом. Если в реакции участвуют водные пары, реакция протекает гораздо быстрее. Ученые выяснили: при нагреве элемента до 500 °C получается WO2 — низкий окислитель с высокой устойчивочтью. Он затягивает поверхность металла коричневой пленкой. Если повышать температуру — можно получить еще один окислитель, который называют промежуточным (W4O11). Он имеет синюю окраску, а если продолжить нагрев до температуры в 923°C, она изменится на лимонно-желтую. Этому будет способствовать WO3.
Если с вольфрамом смешивают сухой фтор, то даже при небольшом подогреве можно получить вещество WF6. Его именуют гексафторидом. Оно может плавиться даже при 2,5 градусах, а кипеть при 19,5. Такое же соединение можно получить и при использовании хлора. Однако для этой реакции потребуется высокая температура — около 600 °C.
Также вольфрам легко вступает в реакции с йодом и бромом. С ними он образовывает такие малоустойчивые соединения как дибромид, ментамид, а также дииодид и тетрадид. При высоких температурах вольфрам соединяется с селеном, азотом, серой, а также с кремнием и углеродом.
Одним из интересных соединений считают карбонил. В этой реакции вольфрам реагирует на окись углерода. Именно здесь и проявляется его нулевая валентность. Однако это вещество сложно назвать устойчивым. Поэтому его можно получить только при создании специальных условий. Из карбонила получают плотные и ультратонкие покрытия чистого вольфрама.
Нужно уделить внимание и вольфрамовым соединениям. Некоторые из них поддаются полимеризации, в частности окись вольфрама
Свойства атома
- Имя, символ, номер — Вольфрам/Wolframium (W), 74
- Атомная масса (молярная масса), г/моль — 183,84 а. е. м.
- Электронная конфигурация — 4f14 5d4 6s2
- Радиус атома, пм — 141
Химические свойства
- Ковалентный радиус, пм — 170
- Радиус иона, пм — (+6e) 62 (+4e) 70
- Электроотрицательность, шкала Полинга — 2.3
- Электродный потенциал, В — W < W3+ 0,11
- W < W6+ 0,68
- Степени окисления — 6, 5, 4, 3, 2, 0
- Энергия ионизации, кДж/моль(1-й ионизац. потенциал, эВ) — 769,7 (7,98)
Термодинамические свойства простого вещества
- Плотность, кг/м3 (при н. у., г/см3) — 19300 (19,3)
- Температура плавления, °C, K — 3422, 3695
- Температура кипения, °C, K — 5555, 5828
- Теплота плавления, кДж/кг, кДж/моль — 191, 35
- Теплота испарения, кДж/кг, кДж/моль — 4482, 824
- Теплоемкость, кДж/(кг·°С) — 0,134
- Молярная теплоемкость, Дж/(K·моль) — 24,27
- Молярный объем, см3/моль — 9,53
Прочие характеристики
- Теплопроводность, K, Вт/(м·К) — 300, 173
- Удельное электросопротивление при 20°С, ом·мм2/м — 5,03
- Коэффициент теплопроводности при 20°С, кал/ (см·сек·град) — 0,4
- Коэффициент линейного расширения, 1/град — 43·10-6
- Временное сопротивление при растяжении, кг/мм2 — 35
Свойства карбидов вольфрама
При высоких значениях температуры плавления, термостойкость карбидов вольфрама – достаточно низкая. Объясняется такое противоречие просто: кристаллическая структура и WC, и W2С – весьма жёсткая, поэтому термическое расширение практически отсутствует. С другой стороны карбид вольфрама обладает значительной теплопроводностью, причём для WC этот параметр с повышением температуры возрастает вдвое интенсивнее, чем у W2С.
Оптимальным диапазоном температур эксплуатации деталей, изготовленных из карбидов вольфрама, считается 200…3000С. С увеличением процентного содержания кобальта в твёрдых сплавах (до 20…25%) допустимые температуры эксплуатации возрастают до 700…8000С, превышая температуростойкость всех известных марок сталей (за исключением жаропрочных).
Карбиды вольфрама – соединения с хорошей электропроводностью, причём для WC этот показатель выше, чем у W2C, практически в 4 раза. Удельное электросопротивление карбидов вольфрама растёт при повышении температуры. Пропорционально этому, кстати, падают показатели упругости. Именно поэтому карбиды вольфрама хорошо обрабатываются электрофизическими методами: локальное введение высококонцентрированного источника тепла (дуга, искра, электрический импульс) повышает температуру в зоне обработки и способствует размерному разрушению структуры рассматриваемых соединений.
С точки зрения практического применения для карбидов вольфрама большее значение имеют их механические показатели – твёрдость и хрупкость. Получаемая в итоге микротвёрдость зависит в основном от температуры, при которой в вольфрамовом порошке формируются карбиды (менее — от степени их пористости). При повышении температуры дефекты в зёрнах залечиваются, поскольку возрастает подвижность атомов вольфрама и углерода. Поэтому конечная микротвёрдость соединений возрастает. При этом анизотропия свойств выражается значительно меньше, чем аналогичный показатель для металлов. Это упрощает предварительное ориентирование заготовки перед её обработкой.
Упругость карбидов вольфрама – максимальная для своего класса соединений тугоплавких металлов с углеродом, причём она возрастает с увеличением пористости
Это обстоятельство важно для изделий (в химсоставе которых присутствуют карбиды вольфрама), работающих в условиях знакопеременных нагрузок
Пластичность карбидов вольфрама крайне низка, и не превышает 0,015%.
Это интересно: Вулканизация резины — процесс, метод, температуна, технология
Как подготовить покрытие заготовки карбида вольфрама?
Во многих случаях готовая деталь должна быть покрыта. Покрытие обеспечивает смазывающую способность и повышенную твердость и обеспечивает диффузионный барьер для подложки, который предотвращает окисление при воздействии высоких температур. Матрица карбида вольфрама имеет решающее значение для характеристик покрытия. В дополнение к основным характеристикам порошка настраиваемой матрицы поверхностные свойства подложки могут быть подобраны путем химического отбора и модификации процесса спекания. Благодаря движению кобальта более кобальт может быть обогащен самым наружным слоем поверхности лопасти толщиной 20-30 мкм относительно остальной части заготовки, тем самым придавая более хорошую ударную вязкость поверхностному слою подложки, имеет сильное сопротивление деформации.
Производители инструмента, основанные на собственных производственных процессах (такие как методы депарафинизации, скорости нагрева, время спекания, температуры и науглероживающие напряжения), могут предъявлять особые требования к классам используемого порошка карбида. Некоторые изготовители инструмента могут спекать заготовки в вакуумных печах, в то время как другие могут использовать спекающие печи с горячим изостатическим прессованием (HIP) (которые герметизируют заготовку в конце технологического цикла для устранения остатков). Pore). Заготовка, спеченная в вакуумной печи, также может быть подвергнута процессу горячего изостатического прессования для увеличения плотности заготовки. Некоторые производители инструмента могут использовать более высокие температуры спекания в вакууме для увеличения спеченной плотности смесей с более низким содержанием кобальта, но этот подход может сделать грубую микроструктуру.
Для поддержания мелкого размера зерна можно использовать порошок с меньшим размером частиц карбида вольфрама. Чтобы соответствовать конкретному производственному оборудованию, условия депарафинизации и науглероживающее напряжение также имеют разные требования к содержанию углерода в порошке карбида вольфрама.Все эти факторы оказывают решающее влияние на микроструктуру и свойства материала инструмента из карбида вольфрама, который спекается. Поэтому существует необходимость в тесной связи между производителем инструмента и поставщиком порошка, чтобы обеспечить его изготовление в соответствии с инструментом. Индивидуальный производственный процесс изготовленный на заказ порошок карбида вольфрама. Поэтому неудивительно, что существуют сотни различных марок карбидов. Например, ATI Alldyne производит более 600 различных марок порошков, каждый из которых специально разработан для предполагаемого пользователя и конкретного использования.
Сплав – карбид – вольфрам
Сплав карбида вольфрама с 16 % кобальта настолько тверд, что может частично заменить алмаз при бурении скважин.
В сплавах карбида вольфрама с молибденом может быть 90 и более процентов твердой фазы. Между частицами карбида вольфрама существуют контакты, хорошо различимые в микроскопе. А в дисперсионно-упрочненных сплавах содержание твердой фазы составляет не более 20 процентов. Твердые частицы упрочняющей фазы изолированы, здесь металлической фазой. Композиция карбида вольфрама с – кобальтом как исключение причислена к классу диспер-сионно-упрочнен ных сплавов. Над загадкой счастливого брака карбида вольфрама и кобальта и технологией получения твердых сплавов на их основе продолжают работать научные коллективы многих стран.
Стеллиты представляют собой сплавы карбидов вольфрама и хрома, связанные кобальтом и железом. Присутствие вольфрама и кобальта удорожает эти сплавы и поэтому они применяются значительно реже сормайта.
Чем больше в сплаве карбида вольфрама, тем сплав тверже, но тем более он хрупок. Вязкость сплава, дающая возможность воспринимать ударные нагрузки, обеспечивается кобальтом. Сплав ВК2, содержащий всего 2 % кобальта, обладает весьма низкой вязкостью.
Чем больше в сплаве карбида вольфрама ( сплавы ВК), тем более он хрупок и менее прочен.
Металлокерамические твердые сплавы представляют собой сплавы карбидов вольфрама и карбидов титана с кобальтом и приготовляются путем прессования и спекания. Эти сплавы применяются для скоростной обработки металлов резанием в виде пластинок, напаиваемых на державку езца. Металлокерамические твердые стали разделяются по ГОСТ 3882 – 53 на две группы.
В табл. 51 приведены некоторые свойства покрытий из сплавов карбида вольфрама.
К первой группе относятся вольфрамовые однокар-бидные сплавы типа ВК ( ВК2, ВКЗМ, ВК4, ВК6, ВК6М, ВК8, ВК8В), представляющие сплав карбида вольфрама с кобальтом, содержание которого колеблется в пределах от 2 до 8 % и выше.
Наиболее подробно изученными являются сплавы монокарбида вольфрама с кубическими карбидами, среди которых особое внимание уделяется сложным карбидам TiC-WC, нашедшим широкое практическое использование в составе металлокерамических твердых сплавов. Показано, что сплавы карбида вольфрама с кубическими карбидами обладают оптимальными свойствами в области твердых растворов
При этом четко проявляется общая тенденция понижения растворимости карбида вольфрама в кубических карбидах при переходе от металлов IV к металлам V группы. Так как в карбиде вольфрама прочность связи Me-С низкая ( из-за незначительной стабилизации 5 / з3 – конфигураций атомов углерода) и WC обладает высоким запасом свободной энергии, то указанный характер изменения растворимости WC в кубических карбидах указывает на различную степень их взаимодействия с карбидом вольфрама, определяемую донорными свойствами металлов карбидов-растворителей.
Еще шире, чем в чистом виде, вольфрам применяется в форме сплавов. Одни из самых важных – металлокврамические сплавы карбида вольфрама и кобальта, которые получили исключительно большое значение, так как Обладают чрезвычайно высокой твердостью.
Вольфрам образует карбиды WC и W2C – вещества, по твердости близкие к алмазу; их применяют в производстве твердых материалов. Большое значение, в частности для буровой техники, имеют сплавы карбида вольфрама с кобальтом, обладающие чрезвычайно большой твердостью. Такой сверхтвердый сплав, называемый победитом, содержит около 90 % карбида вольфрама и около 10 % кобальта.
| Типы ( модели и технические характеристики двухшнековых машин. |
Оба шнековых вала выполнены из нитрированной стали. При желании для переработки абразивных материалов они могут быть полностью или частично покрыты сплавом карбидов вольфрама. Корпус машины охватывает зоны загрузки, смешения и участок дросселирующего элемента. К нему на фланцах присоединен корпус с двумя цилиндрами для разгрузочных шнеков. Корпус этих шнеков изготовлен также из нитрированной стали. Он укреплен на станине машины откидными болтами и при чистке машины может отводиться на роликах.
Металлический – кобальт, серовато-стального цвета, по внешнему виду сходен с железом, но тверже его и никеля. В тонко раздробленном состоянии он легко окисляется во влажном воздухе. При температуре белого каления он сгорает в СозО – i. Из сплавов кобальта назовем стеллит, сталь, содержащую кобальт и хром, отличающуюся весьма большой твердостью и противокоррозийными свойствами; карбалой, сплав карбида вольфрама с кобальтом, также отличается своей очень большой твердостью; магнитную сталь, содержащую 35 % кобальта. Окись кобальта служит для окраски стекла и эмали в синий цвет.
Применение вольфрама
Большинство областей применения вольфрама используют такие его качества, как высокая температура плавления, плотность и пластичность. Вольфрам незаменим в следующих областях:
- Чистый вольфрам, это единственный металл, который применяется в нитях накаливания осветительных ламп, радиолампах, кинескопах и прочих электровакуумных приборах;
- В чистом виде и в составе сплавов используется при производстве сердечников подкалиберных бронебойных снарядов и пуль;
- Высокая плотность вольфрама позволяет изготавливать роторы малогабаритных гироскопов ракетной техники и космических аппаратов;
- Изготовление неплавящихся электродов при аргонно-дуговой сварке;
- Устройства защиты от ионизирующих излучений из вольфрама эффективнее, чем традиционные свинцовые. Использование вольфрама экономически выгодно, несмотря на более высокую стоимость, чем у свинца. Это вызвано тем, что расход вольфрама при тождестве технических характеристик изделия намного меньше.
- Изделия из вольфрама не нуждаются в защите от коррозии благодаря низкой химической активности при нормальных температурных условиях.

Сверла из вольфрама
Соединения вольфрама с углеродом более известны как «победит». Их высокая твердость используется в режущих напайках металлообрабатывающих инструментов — резцов, сверл, фрез. Инструменты с победитовыми напайками используются для обработки практически любых материалов, начиная от древесины, где почти не требуют периодической заточки, до любых пород камня. Для заточки победитовых инструментов требуются абразивы с самой высокой твердостью. В полной мере этому соответствуют алмазные и эльборовые абразивы имеющие самую высокую твердость среди всех известных.
Победитовые напайки крепятся к рабочим кромкам инструмента при помощи пайки медью. В качестве флюса используется бура.
Победит изготавливают порошковым методом, используя для скрепления кристаллом карбида вольфрама кобальт.
Карбиды вольфрама
Твердые сплавы рассмотрим более подробно. Тугоплавкий металл может образовывать разные карбиды: полукарбид и монокарбид. Они отличаются способностью растворять в себе тугоплавкие металлы и взаимодействием с разными кислотами.
Вольфрам — металл имеющий разные карбиды
Также монокарбид уступает поликарбиду в устойчивости и твердости. А к преимуществам монокарбида можно отнести способность к образованию кристаллов в расплавленном вольфраме, что дает возможность использовать его в минералокерамических изделиях. Полукарбид обладает большей устойчивостью к температурам, легкостью внедрения в твердые растворы монокарбида с другими металлами (феррумом, кобальтом), повышенной износоустойчивостью.
Это интересно: Как правильно закалить нож в домашних условиях
Химические свойства
Валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и практического значения не имеют.
Вольфрам имеет высокую коррозионную стойкость: при комнатной температуре не изменяется на воздухе; при температуре красного каления медленно окисляется в ангидрид вольфрамовой кислоты; в соляной, серной и плавиковой кислотах почти не растворим. В азотной кислоте и царской водке окисляется с поверхности. В смеси азотной и плавиковой кислоты растворяется, образуя вольфрамовую кислоту. Из соединений вольфрама наибольшее значение имеют: триоксид вольфрама или вольфрамовый ангидрид, вольфраматы, перекисные соединения с общей формулой Me2WOX, а также соединения с галогенами, серой и углеродом. Вольфраматы склонны к образованию полимерных анионов, в том числе гетерополисоединений с включением других переходных металлов.
Продукция из вольфрама
Промышленностью выпускается большое разнообразие продукции из данного тугоплавкого материала. Наиболее распространены вольфрамовые электроды, проволока, вольфрамовый порошок, штабик, лист.
Электроды являются неплавящимися и используются для сварки цветных металлов, высоколегированных сталей, материалов разного химического состава. Они обеспечивают высокую прочность сварного шва. Из вольфрамовой проволоки изготовляют нагреватели, спирали для ламп накаливания. Термоэлектродная проволока из сплава W-Re применяется для изготовления термопар, с помощью которых можно измерять высокие температуры. Порошок вольфрама является основой многих жаропрочных сталей и сплавов и твердых сплавов. Так, например, данный порошок является основой твердого сплава ВК8.
Свойства и марки вольфрама
Вольфрам имеет свои механические и физические свойства, а также несколько разновидностей марок.
К физическим свойствам относят:
- Коэффициент термического линейного расширения — 4,32*10 (-6) м/мК.
- Сопротивление электрическое — 5,5 мкОм*см.
- Теплопроводность — 129 Вт/(м*К).
- Теплоёмкость удельная — 0,147 Дж/(г*К).
- Температура кипения — 5900 градусов.
- Температура плавления — 3380 градусов.
- Плотность — 19,3 г/см3.
- Атомный диаметр — 0,274 нм.
- Атомная масса — 183,84 г/моль.
- Атомный номер — 74.
Механические свойства:
- Относительное удлинение — 0%.
- Временное сопротивление — 800−1100 МПа.
- Коэффициент Пуассона 0,29.
- Модуль сдвига — 151,0 ГПа.
- Модуль упругости — 415,0 ГПа.
Отличается этот металл маленькой скоростью испарения даже при 2 тыс. градусов и очень большой точкой кипения — 5900 градусов. Свойствами, которые ограничивают область использования этого материала, являются малое сопротивление окислению, высокая склонность к ломкости и высокая плотность. На вид он напоминает сталь. Используется для того, чтобы изготавливать сплавы высокой прочности. Обработать его можно только после нагревания. Температура нагрева зависит от того, какой именно метод обработки вы собираетесь проводить.
Вольфрам имеет такие марки:
- МВ — сплав вольфрама и молибдена. Повышается прочность молибдена при сохранении пластичности после обжига.
- ВРН — вольфрам без присадки. В нём допустимо повышенное содержание примесей.
- ВР — сплав рения и вольфрама.
- ВЛ, ВИ, ВТ — вольфрам с присадкой окиси лантана, иттрия и тория соответственно. Повышают эмиссионные свойства вольфрама.
- ВМ — вольфрам с ториевой и кремнещелочной присадками. Повышает температуру рекристаллизации и прочность при высоких температурах.
- ВА — вольфрам с алюминиевой и кремнещелочной присадками. Увеличивает температуру первичной рекристаллизации, формоустойчивость при больших температурах, а также прочность после отжига.
- ВЧ — чистый без присадок.